
【题目】已知:① X、Y、Z、W、R、Q为原子序数依次增大的短周期元素。X 是所有元素中原子半径最小的元素,Y是形成化合物种类最多的元素,W的最外层电子数是次外层电子数的3倍,Q与W同主族,Y、R原子的最外层电子数之和等于Z的最外层电子数。
②莱纳斯·卡尔·鲍林在1932年提出electronegativity作为元素原子在化合物某种性质的标度,electronegativity的大小可以判断元素金属性与非金属性强弱,下表列出部分短周期元素的Electronegativity的值。
元素 | X | Y | Z | W | R | Q |
electronegativity | 2.1 | 2.5 | 3.0 | 3.5 | 0.9 | 2.5 |
元素 | Mg | Li | Al | Cl | P | Be |
electronegativity | 1.2 | 1.0 | 1.5 | 3.0 | 2.1 | 1.5 |
请回答下列问题(涉及X、Y、Z、W、R、Q时,用元素符号表示):
(1)根据上表给出的数据,可知元素的electronegativity越大,__(填“金属性”或“非金属性”)越强。
(2)元素Q在周期表中的位置为_________。
(3)W、R、Q单核简单离子半径由大到小排列顺序为______。
(4)元素X、Z、W之间能形成多种10电子微粒,请写出反应物和产物均为X、Z、W之间形成的10电子微粒的一个离子方程式______________。
(5)一种由元素W、R组成的白色固体化合物,其电子式为_______________。
(6)试比较稳定性:X2W_____ X2Q;沸点:X2W_____ X2Q (填“<”或“>”)。
(7)元素 X、Y、Z、W、R、Q中的两种元素可形成原子个数比为1∶2的共价化合物,则这两种元素的原子序数之差不可能是_________。
A.2 B.4 C.5 D.7
【答案】非金属性 第三周期VIA族 S2->O2->Na+ NH4++OHˉ![]() NH3↑+ H2O(或NH3 + H3O+=NH4++ H2O或H3O++OHˉ=2H2O等)
NH3↑+ H2O(或NH3 + H3O+=NH4++ H2O或H3O++OHˉ=2H2O等) ![]() > > B
> > B
【解析】
X、Y、Z、W、R、Q为原子序数依次增大的短周期元素,由X是所有元素中原子半径最小的元素可知,X为H元素;由Y是形成化合物种类最多的元素可知,Y是C元素;由W的最外层电子数是次外层电子数的3倍可知,W是O元素、Z是N元素;由Q与W同主族可知,Q是S元素;由Y、R原子的最外层电子数之和等于Z的最外层电子数可知,R的最外层电子数为1,则R为Na元素。
(1)根据上表给出的数据可知,元素的electronegativity代表电负性,电负性表示对键合电子的吸引力,电负性越大对键合电子吸引力越大,所以电负性越强非金属性越强,故答案为:非金属性;
(2) Q为S元素,位于元素周期表第三周期第VIA族,故答案为:第三周期第VIA族;
(3)氧离子和钠离子电子层结构相同,由电子层结构相同的离子,随核电荷数增大,离子半径依次减小可知,氧离子半径大于钠离子;同主族元素,从上到下离子半径依次增大,则硫离子半径大于氧离子,则离子半径由大到小排列顺序为S2->O2->Na+,故答案为:S2->O2->Na+;
(4)H、N、O三种元素形成的10电子微粒有氨气、水、铵根离子、氢氧根离子和水合氢离子,其中微粒能发生反应的有铵根离子与氢氧根离子反应可以生成氨气和水,反应的化学方程式为NH4++OHˉ![]() NH3↑+ H2O;氨气与水合氢离子反应生成铵根离子和水,反应的化学方程式为NH3 + H3O+ =NH4++ H2O;水合氢离子和氢氧根离子反应生成水,反应的化学方程式为H3O++OHˉ=2H2O,故答案为:NH4++OHˉ
NH3↑+ H2O;氨气与水合氢离子反应生成铵根离子和水,反应的化学方程式为NH3 + H3O+ =NH4++ H2O;水合氢离子和氢氧根离子反应生成水,反应的化学方程式为H3O++OHˉ=2H2O,故答案为:NH4++OHˉ![]() NH3↑+ H2O(或NH3 + H3O+ =NH4++ H2O或H3O++OHˉ=2H2O等);
NH3↑+ H2O(或NH3 + H3O+ =NH4++ H2O或H3O++OHˉ=2H2O等);
(5)由钠、氧元素组成的白色固体化合物为氧化钠,氧化钠为离子化合物,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(6)元素的非金属性越强,氢化物的稳定性越强,氧元素的非极性强于硫元素,则水的稳定性强于硫化氢;水分子间可以形成氢键,硫化氢分子间不能形成氢键,则水的沸点高于硫化氢,故答案为:>;>;
(7)二氧化碳是共价化合物,分子中碳氧原子个数比为1:2,氧和碳原子序数差为2;肼是共价化合物,分子中氮氢原子个数比为1:2,氮和氢的原子序数差为5;水是共价化合物,分子中氧氢原子个数比为1:2,氧和氢原子序数差为7,则可形成原子个数比为1∶2的共价化合物中两种元素的原子序数之差不可能是4,B符合题意,故答案为:B。


科目:高中化学 来源: 题型:
【题目】某温度下,在容积为1L的密闭容器中充入![]() 和
和![]() 发生
发生![]() 测得
测得![]() 的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数
的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数![]() )下列说法正确的是 ( )
)下列说法正确的是 ( )
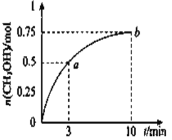
A. ![]()
B. 点b所对应的状态为化学平衡状态
C. ![]() 的生成速率,点a低于点b
的生成速率,点a低于点b
D. 欲增大平衡状态时![]() ,可保持其他条件不变,升高温度
,可保持其他条件不变,升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表诞生150周年,元素周期表(律)在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
族 周期 | IA | 0 | ||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ||||||||
(1)元素①~⑧中,金属性最强的是________(填元素符号)。
(2)中国青年化学家姜雪峰被国际组织推选为“元素⑦代言人”,元素⑦的原子结构示意图是________,其氢化物的电子式是_________。
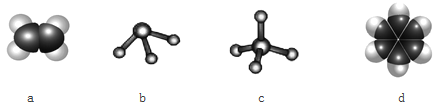
(3)元素①和②可以形成多种化合物。下图模型表示的分子中,不可能由①和②形成的是_______(填序号)。
(4)比较元素②、③的最高价氧化物对应水化物的酸性:______>______(填化学式)。说明你判断的理由:_________。
(5)主族元素砷(As)的部分信息如图所示。
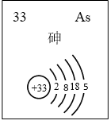
i.砷(As)在周期表中的位置是______。
ii.下列说法正确的是_______(填序号)。
a. 砷元素的最高化合价为+4
b. 推测砷有多种氧化物
c. ③的气态氢化物的还原性大于砷的气态氢化物的还原性
(6)某小组同学设计实验比较VIIA元素的非金属性:Cl>Br>I。
已知:常温下浓盐酸与高锰酸钾反应生成氯气。
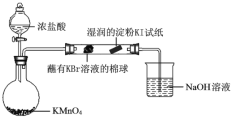
打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙红色,湿润的淀粉KI试纸变蓝,据此现象能否说明非金属性:Br > I,并说明理由_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,X比Y的原子系数小1,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是

A.Y原子能形成四核18电子的电中性分子
B.元素非金属性的顺序为X>Y>Z
C.W的单质与氧气反应不能产生含共价键的化合物
D.该新化合物中Y不满足最外层8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题
Ⅰ.下列物质组别中:A.冰与水 B.H2、D2、T2 C.O2与 O3 D. ![]() 与
与![]() E.CH3—CH2—CH2—CH3与
E.CH3—CH2—CH2—CH3与![]() F.
F.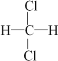 与
与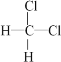 G.甲烷和庚烷。
G.甲烷和庚烷。
①互为同位素的是_________(填组别选项,下同);
②互为同素异形体的是_________;
③互为同分异构体的是_________;
④属于同一物质的是_________;
⑤属于同系物的是_________。
Ⅱ.(1)乙烯使溴水褪色的反应类型和使酸性高锰酸钾溶液褪色的反应类型_______(填“相同”或“不相同”)。
(2)用苯制备溴苯的化学方程式是_____________________,该反应的类型_________。
(3)已知 2CH3CHO+O2![]() 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如图所示。则反应②的化学方程式为______________,该反应的类型为__________。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如图所示。则反应②的化学方程式为______________,该反应的类型为__________。
![]()
Ⅲ.在光照条件下,CH4与Cl2能发生取代反应。若将1 mol CH4与一定量Cl2反应,待反应完全测得四种有机取代产物的物质的量之比为 n(CH3Cl)∶n(CH2Cl2)∶n(CHCl3)∶n(CCl4)=1∶1∶1∶1,则消耗的Cl2物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的有几个()
①质子数相同的微粒一定属于同一种元素
②同一元素的核素种数由中子数决定
③18gH2O中含有的中子数为10NA
④标准状况下,等体积CH4和HF所含的分子数相同
⑤通过化学变化可以实现![]() 与
与![]() 之间的相互转化
之间的相互转化
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag++Cu=Cu2++2Ag设计的原电池如图所示。请回答下列问题:
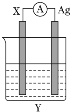
(1)电极X的材料是________;
(2)X电极发生的电极反应式为____________________;银电极上发生的电极反应为________(填“氧化”或“还原”)反应。
(3)外电路中的电子________(填“流出”或“流向”)Ag电极。
(4)当有3.2 g铜溶解时,银电极增重________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物K是某药物的前体,合成路线如图所示:

已知:R-CN![]()
![]() ;
;
![]()
![]() +
+![]()
(1)A的名称是_____________。
(2)反应①的化学方程式是___________________。
(3)反应②的类型是__________________。
(4)反应③中的试剂X是________________。
(5)E属于烃,其结构简式是_________________。
(6)H中所含的官能团是_________________。
(7)反应⑥的化学方程式是_____________________。
(8)H经三步反应合成K,写出中间产物I和J的结构简式______________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】激素类药物己烯雌酚的结构简式如图所示。下列叙述正确的是
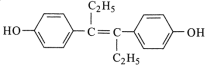
A.己烯雌酚是芳香烃
B.1mol己烯雌酚可与6molH2发生加成反应
C.1mol己烯雌酚完全燃烧能生成18molCO2和12 molH2O
D.己烯雌酚苯环上的一氯代物有两种(不包括立体异构)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com