
| A、0.784 | B、0.896 |
| C、1.00 | D、1.12 |
| 1 |
| 2 |
| 0.03mol×2+0.03mol×2 |
| 5-2 |
| 0.03mol×3+0.03mol×2 |
| 5-2 |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 锥形瓶中溶液 | 滴定管中溶液 | 指示剂 | 滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 石蕊 | (乙) |
查看答案和解析>>
科目:高中化学 来源: 题型:
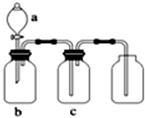 如图装置可用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是( )
如图装置可用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是( ) | 选项 | 气体 | a | b | c |
| A | 二氧化氮 | 浓硝酸 | 铜片 | 氢氧化钠溶液 |
| B | 二氧化硫 | 浓硫酸 | 铜片 | 酸性高锰酸钾溶液 |
| C | 氨 | 浓氨水 | 生石灰 | 碱石灰 |
| D | 二氧化碳 | 稀盐酸 | 碳酸钙 | 浓硫酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,冷却水应从冷凝器下端进入 |
| C、蒸发时,要用玻璃棒不断搅动溶液 |
| D、过滤时,将待过滤的液体直接倒入漏斗,使液面低于滤纸的边缘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将pH=5的硫酸溶液稀释1000倍后,溶液中的SO42-与H+浓度的比值约为1:20 |
| B、0.1 mol/L NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2 c(CO32-) |
| C、将0.2 mol/L NaA溶液和0.1 mol/L盐酸溶液等体积混合所得溶液显碱性且有:c(Na+)+c(H+)=c(A-)+c(Cl-) |
| D、pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,由水电离出来的c(H+)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、X分子中所有碳原子可能处在同一个平面上 |
| B、1 mol X与浓溴水反应时最多消耗2mol Br2 |
| C、X可以发生加成、加聚、氧化、还原、消去等反应 |
| D、1个X与足量H2完全反应的产物中含有3个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 低碳生活是一种时尚的生活理念,如何有效地开发利用碳资源以及降低大气中CO2的含量的研究显得更加紧迫.
低碳生活是一种时尚的生活理念,如何有效地开发利用碳资源以及降低大气中CO2的含量的研究显得更加紧迫.物质T/℃n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com