
【题目】(1)配平该方程式__KMnO4+__HCl (浓) =__KCl+__MnCl2+__Cl2↑+__H2O
(2)反应中(1)中____是还原剂,_____是还原产物 .
(3)该反应的离子方程式为:_______________________
(4)用双线桥法分析此氧化还原反应____________________________
(5)NA表示阿伏伽德罗常数,若产生标准状况下的气体的体积为2.24L ,则反应过程中转移电子的数目为_________,被氧化的HCl的质量为_____g
【答案】2 16 2 2 5 8 HCl MnCl2. 2MnO4- +16H+ +10Cl- =2Mn2+ +5Cl2↑+8H2O 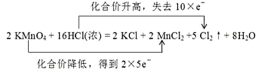 0.2NA 7.3
0.2NA 7.3
【解析】
在2KMnO4+16HCl (浓) =2KCl+2MnCl2+5Cl2↑+8H2O反应中,Mn元素的化合价降低,Cl元素的化合价升高,在离子反应中,气体和水应保留化学式,并根据化合价的变化判断转移的电子数,以此来解答。
(1)反应中KMnO4→MnCl2,锰元素中由+7价降低到+2价,降低了5价;2HCl→Cl2,氯元素由-1价升高到0价,生成了氯气,化合价升高了2价,根据氧化还原反应中化合价升降总数相等规律可知,KMnO4填系数2,Cl2填系数5,然后根据原子守恒配平其它物质的系数,具体如下:2KMnO4+16HCl (浓)=2KCl+2MnCl2+5Cl2↑+8H2O;
综上所述,本题答案是:2 ,16,2,2,5, 8。
(2)反应中(1)中氯元素的化合价升高,HCl做还原剂;反应中Mn元素的化合价降低,还原产物为MnCl2;
综上所述,本题答案是:HCl,MnCl2。
(3)在离子反应中,气体和水应保留化学式,该反应的离子反应为2MnO4- +16H+ +10Cl- =2Mn2+ +5Cl2↑+8H2O;
综上所述,本题答案是:2MnO4- +16H+ +10Cl- =2Mn2+ +5Cl2↑+8H2O。
(4)该反应中Mn得到2×5e-,Cl失去10e-,则双线桥法表示反应转移的电子的方向和数目为: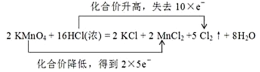 ;
;
综上所述,本题答案是: 。
。
(5)产生标准状况下的气体的体积为2.24L,物质的量为0.1mol;根据反应关系:10e---5Cl2,若生成0.1mol氯气,则反应过程中转移电子的数目为0.2NA;根据10e--10HCl(被氧化)-5Cl2关系,若生成0.1mol氯气,被氧化的HCl的物质的量为0.2mol;其质量为0.2mol×36.5=7.3g;
综上所述,本题答案是:0.2NA;7.3。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】常温下,在下列溶液中可能大量共存的离子组是
A. pH=0的溶液:Fe2+、Mg2+、NO3-、SO42-
B. 在滴加石蕊试液后呈红色的溶液中:Na+、K+、Al3+、CO32-
C. ![]() 的溶液中:NH4+、SO42-、NO3-、CO32-
的溶液中:NH4+、SO42-、NO3-、CO32-
D. 由水电离出的c(H+)=1×10-13mol/L的溶液:Al3+、NH4+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的恒容密闭容器中发生反应xA(g)+ yB(g)![]() zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系;则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系;则下列结论正确的是
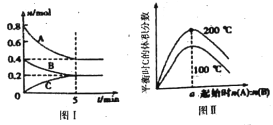
A. 图II所知反应xA(g)+yB(g) ![]() zC(g) △H<0,且a=2
zC(g) △H<0,且a=2
B. 200℃时,该反应的平衡常数为25
C. 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol/(Lmin)
D. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于平衡体系:aA(g)+bB(g)![]() cC(g)+dD(g) △H<0,下列判断其中不正确的是
cC(g)+dD(g) △H<0,下列判断其中不正确的是
A. 若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.45倍,则a+b<c+d
B. 若从正反应开始,平衡时,A、B的转化率相等,则投入A、B的物质的量之比为a:b
C. 若平衡体系中共有气体Mmol,再向其中充入bmolB,达到平衡时气体总物质的量为( M+b)mol,则a+b=c+d
D. 若a+b=c+d,对于体积不变的容器,升高温度,平衡向左移动,容器中气体的压强不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备硅单质时,主要化学反应如下:
(1)SiO2+2C![]() Si+2CO↑
Si+2CO↑
(2)Si+2Cl2![]() SiCl4
SiCl4
(3)SiCl4+2H2![]() Si+4HCl
Si+4HCl
下列对上述三个反应的叙述中,不正确的是( )
A. (1)(3)为置换反应 B. (1)(2)(3)均为氧化还原反应
C. (2)为化合反应 D. 三个反应的反应物中硅元素均被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F、G、H、M九种物质,其中A为淡黄色粉末,B为日常生活中最常见无色无味液体, E为无色气体单质,F的水溶液与石灰水混合可得D的溶液,G为黄绿色气体单质,H是漂白液的有效成分,它们之间的相互转化关系如图所示,其他与题无关的生成物均已略去。
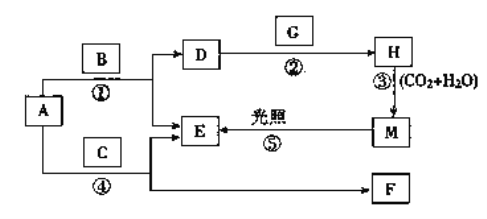
请回答下列问题:
(1)写出G、H的化学式:G________,H________。D的俗名是__________。
(2)写出反应②的离子方程式:_________________________________________。
(3)利用下图装置进行实验,证明氧化性强弱:KMnO4>Cl2>Br2。
限选试剂:KBr溶液、KMnO4、浓盐酸。
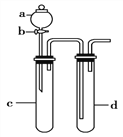
已知:2KMnO4+16HCl(浓)=2KCl+ 2MnCl2+5Cl2↑+8H2O
请回答下列问题:
装置a 的名称是____________________,d中盛放的试剂是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH) 2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
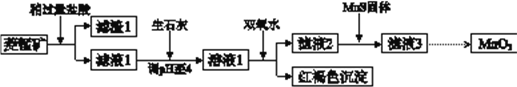
已知:生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是_________。盐酸溶解MnCO3的化学方程式是_________。
(2)向溶液1中加入双氧水时,反应的离子方程式是___________。
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是__________。
(4)将MnCl2转化为MnO2的一种方法是氧化法。用酸化的NaClO3溶液将MnCl2氧化生成MnO2和Cl2,该反应的离子方程式为___________。
(5)将MnCl2转化为MnO2的另一种方法是电解法。
① 生成MnO2的电极反应式是___________。
② 若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2。检验Cl2的操作是_________。
③ 若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生。其原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中滴入酚酞试液显红色,该溶液中可以大量共存的离子组是
A.Mg2+、Al3+、HCO3-、SO32- B.K+、Ca2+、MnO4-、Cl-
C.Ba2+、Na+、AlO2-、NO3- D.NH4+、Fe3+、SO42-、SCN-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com