
| 放电 |
| 充电 |
| A、可加入硫酸以提高电解质的导电性 |
| B、放电时电池内部Li+向负极移动. |
| C、充电过程中,电池正极材料的质量不变 |
| D、放电时电池正极反应为:FePO4+Li++e-=LiFePO4 |


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制氯水只含Cl2和H2O分子 |
| B、新制氯水可使蓝色石蕊试纸先变红后褪色 |
| C、光照氯水有气泡逸出,该气体是Cl2 |
| D、氯水放置数天后PH将变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H++2e-=H2 |
| B、Fe2++2e-=Fe |
| C、Fe-2e-=Fe2+ |
| D、O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③④ | C、②④ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 加入药品 | 不加MnSO4的 稀硫酸酸化的 H2C2O4溶液 | 加少量MnSO4的 稀硫酸酸化的 H2C2O4溶液 |
| 实验现象 (褪色时间) | 溶液褪色很慢 (31秒) | 溶液褪色很快 (4秒) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知化学反应N2+3H2═2NH3的能量变化如图所示:
已知化学反应N2+3H2═2NH3的能量变化如图所示:| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
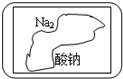 现有一盛有无色固体物质M的试剂瓶,标签已破损(如图).已知硫酸、盐酸、硝酸等是强酸,碳酸、氢硫酸、亚硫酸、醋酸等是弱酸,烧碱、苛性钾等是强碱,一水合氨等是弱碱.由强酸与强碱组成的正盐呈中性,由强酸弱碱组成的正盐呈酸性,由弱酸强碱组成的正盐呈碱性.
现有一盛有无色固体物质M的试剂瓶,标签已破损(如图).已知硫酸、盐酸、硝酸等是强酸,碳酸、氢硫酸、亚硫酸、醋酸等是弱酸,烧碱、苛性钾等是强碱,一水合氨等是弱碱.由强酸与强碱组成的正盐呈中性,由强酸弱碱组成的正盐呈酸性,由弱酸强碱组成的正盐呈碱性.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com