
【题目】碘化亚铜(Cu2I2)是一种不溶于水也不溶于酸的白色固体,用途很广泛。完成下列填空:
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜。写出该反应的化学方程式 。
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去。写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是_____________ _ ______。
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为:2Cu2I2 + Hg=Cu2HgI4(玫瑰红)+ 2Cu,产物Cu2HgI4中Cu元素显____价。当有1 molCu2I2参与反应时,转移电子____mol。
(4)为除去稀盐酸中少量CuCl2杂质,可往溶液中加入过量的M试剂后进行过滤操作,再通入适量的Cl2后进行N操作。试剂M和操作N的组合正确的是_____(选填编号)

【答案】(1)4KI+2CuSO4=I2+Cu2I2↓+2K2SO4
(2)H2SO3、KI、Cu2I2
(3)+1;1(4)bd
【解析】
试题分析:(1)反应中KI中I元素的化合价由-1价升高0生成单质碘I2,失去2e-,CuSO4中Cu元素的化合价由+2价降低为+1价,得到e-,根据得失电子数目相等可知二者最小公倍数数为2,则硫酸铜前的系数为2,碘化亚铜前的系数为1,则结合质量守恒定律可知平衡后的化学方程式为4KI+2CuSO4=I2+Cu2I2↓+2K2SO4;
(2)由(1)解答可知,KI为还原剂,Cu2I2为还原产物,所以还原性KI>Cu2I2,往上述反应后溶液中加入淀粉,溶液变蓝,是因为碘单质和淀粉显示蓝色,再滴加亚硫酸溶液,蓝色又褪去是因为发生H2SO3+I2+H2O=H2SO4+HI,该反应中H2SO3是还原剂,I-是还原产物,还原性H2SO3>I-;故还原性由强到弱的顺序是H2SO3、KI、Cu2I2;
(3)根据在化合物中正负化合价代数和为零可知:在Cu2HgI4中,铜元素的化合价为:x×2+(+2)+(-1)×4=0,则x=+1;反应2Cu2I2+Hg=Cu2HgI4(玫瑰红)+ 2Cu中,Cu元素化合价部分由+1价降低到0价,被还原,Cu2I2为氧化剂,Hg元素化合价由0价升高到+2价,Hg为还原剂,当有1molCu2I2参与反应时,只有1molCu元素的化合价发生变化,转移1mol电子;
(4)a、杂质CuCl2与碘化钾溶液反应生成Cu2I2、碘单质和氯化钾,氯化钾是新杂质,a错误;b、杂质CuCl2与氢碘酸溶液反应生成Cu2I2、碘单质和盐酸,先过滤,后萃取分液,可得盐酸,b正确;c、杂质CuCl2与氢气不反应,c错误;d、杂质CuCl2与氢硫酸溶液,生成硫化铜沉淀和盐酸,过滤即可除去,d正确;答案选bd。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】四苯基乙烯(TPE)及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛。以下是TPE的两条合成路线(部分试剂及反应条件省略):

(1)A的名称是 ;试剂Y为 。
(2)B→C的反应类型为 ;B中官能团的名称是 ,
D中官能团的名称是 。
(3)E→F的化学方程式是 。
(4)W是D的同分异构体,具有下列结构特征:①属于萘(![]() )的一元取代物;
)的一元取代物;
②存在羟甲基(-CH2OH)。写出W所有可能的结构简式: 。
(5)下列叙述正确的是______。
a. B的酸性比苯酚强
b. D不能发生还原反应
c. E含有3种不同化学环境的氢
d. TPE既属于芳香烃也属于烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等。
(1)新制的绿矾(FeSO4·7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式: 。
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃。
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”。

上述装置Ⅲ和Ⅳ用来检验气体产物。试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在 (选填“0℃、25℃、50℃”),装置Ⅱ的作用是 。
②装置Ⅲ中的试剂可以是 (选填序号,下同),现象是 ,则证明气体产物中含有SO3;装置Ⅳ中的试剂可以是 。
A.2mol/LNa2CO3溶液
B.品红溶液
C.0.5mol/L BaCl2溶液
D.0.5mol/LBa(NO3)2
E.0.01mol/L KMnO4溶液
F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为 。
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
操作步骤 | 预期实验现象 | 预期实验结论 |
向其中一份溶液中加入 | 固体中含有Fe2O3 | |
向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 |
⑤若用22.8g FeSO4固体做实验,完全分解后,得到11.2g固体,其中Fe2O3的质量分数= (精确到0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的有机产物,肯定是一种的是( )
A. 异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B. 2—氯丁烷(![]() )与NaOH溶液共热发生反应
)与NaOH溶液共热发生反应
C. 甲苯在一定条件下发生硝化生成一硝基甲苯的反应
D. 等物质的量的甲烷和氯气的混和气体长时间光照后的产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。

(1)上表中与A属于同一周期的元素是 (填元素名称);写出B的单质的电子式 。
(2)D和B形成的化合物的化学式为 。
写出A单质与水反应的离子方程式 。
(3)对B、C的单质或化合物描述正确的是 。
a.C元素的最高正价为+7 b.常温、常压下C单质性质稳定
c.B的氧化物只有两种 d.C单质分子中含有18个电子
(4)从海水中提取D的单质可按如下步骤进行:①把贝壳制成石灰乳;②向引入的海水中加入石灰乳,沉降、洗涤、过滤沉淀物;③将沉淀物与盐酸反应,结晶、过滤、干燥;④ 电解得到产物。以上提取D的单质的过程中,没有涉及的化学反应类型是
a.分解反应 b.化合反应 c.复分解反应 d.置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某有机物的结构简式如图所示,关于该有机物的说法不正确的是

A.该有机物的化学式为C20H14O5
B.该有机物分子中的三个苯环不可能共平面
C.该有机物可发生加成、取代、氧化、消去等反应
D.1 mol该有机物与足量NaOH溶液充分反应,消耗NaOH的物质的量为500mol
II.绿原酸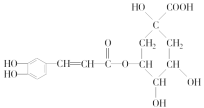 是一种抗氧化药物,存在如图所示的转化关系。
是一种抗氧化药物,存在如图所示的转化关系。

(1)绿原酸中的含氧官能团有酯基、________。
(2)B的分子式是__________________。
(3)C的氧化产物能发生银镜反应,则C→D的化学方程式是_______________。
(4)咖啡酸苯乙酯的结构简式是_______。
(5)1 mol A与足量的H2、浓溴水作用,最多可消耗H2________mol,浓溴水________mol。
(6)F是A的同分异构体,F分别与碳酸氢钠溶液或新制Cu(OH)2溶液反应产生气体或红色沉淀;苯环上只有两个取代基,且核磁共振氢谱表明该有机物中有8种不同化学环境的氢。
①符合上述条件的F有________种可能的结构;
②若F还能与NaOH在常温下以物质的量之比1∶2完全反应,其化学方程式为________ (任写1个)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
![]()

请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为 (注明反应条件)。
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在_____________,目的是 ;当试管A内的主要反应完成后温度计水银球的位置应在___________________,目的是____________________。
(3)烧杯B的作用是___________________________,烧杯B内盛装的液体可以是____________(写出一种即可,在题给物质中找)。
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末。实验仪器任选。该方案为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lg(Ag+),Ksp(AgCl)=1×10-12。如图是向10mLAgNO3溶液中逐渐加入0.1mol![]() L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线)。根据图像所得下列结论正确的是[提示:Ksp(AgCl) >Ksp(AgI)]
L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线)。根据图像所得下列结论正确的是[提示:Ksp(AgCl) >Ksp(AgI)]

A.相同温度下,AgCl在纯水和在NaCl溶液中的溶解度相等
B.原AgNO3溶液的物质的量浓度为0.1mol![]() L-1
L-1
C.图中x点的坐标为(100,6)
D.把0.1mol![]() L-1的NaCl溶液换成0.1mol
L-1的NaCl溶液换成0.1mol![]() L-1的NaI溶液则图像变为虚线部分
L-1的NaI溶液则图像变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室小组偶然发现将镁条插入饱和NaHCO3溶液中,镁条表面出现大量气泡。为了探究产生此现象的原因,该小组设计实验探究如下:
(1)用固体NaHCO3配置饱和NaHCO3溶液的操作过程 。
饱和NaHCO3溶液pH=8.4,用离子方程式表示 。
(2)请完成以下实验设计(镁条已擦去氧化膜且表面积大致相同。表中不要留空格):
序号 | 实验操作 | 实验现象 | 实验结论 |
1 | 将镁条投入5ml蒸馏水 | 微量气泡 | |
2 | 将镁条投入5ml饱和NaHCO3溶液中 | Mg与NaHCO3溶液剧烈反应 | |
3 | 将镁条投入5ml pH= NaOH溶液中 | 现象不明显 | Mg与NaOH溶液较难反应 |
(3)对于反应②中产生的气体(不考虑水蒸气),请你完成假设二和假设三:
假设一:只有CO2;假设二:只有 ;假设三:
(各1分)
为检验其中是否含有CO2,写出实验步骤和结论。
实验步骤 | 想象和结论 |
大试管中加入擦去氧化膜的镁条
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com