

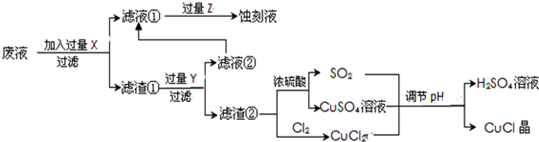
·ÖĪö ŗ£Ė®·ÖĄėµĆµ½“ÖŃĪ”¢ÄøŅŗŗĶµĖ®£¬“ÖŃĪĢį“æµĆµ½¾«ŃĪ£¬µē½āĀČ»ÆÄʵƵ½ĀČĘų£¬ÄøŅŗÖŠĶØČėĀČĘųŃõ»ÆäåĄė×ӵƵ½äåµ„ÖŹ£¬ÓĆČČæÕĘų“µ³öäåµ„ÖŹ£¬ĀĖŅŗÖŠ¼ÓČė±“æĒ·Ö½āÉś³ÉµÄŃõ»ÆøĘČÜÓŚĖ®Éś³ÉµÄĒāŃõ»ÆøĘ£¬³ĮµķĆ¾Ąė×ÓÉś³ÉĒāŃõ»ÆĆ¾³Įµķ£¬¹żĀĖŗóŌŚ³ĮµķÖŠ¼ÓČėŃĪĖįČܽāŗóÕō·¢ÅØĖõ£¬ĄäČ“½į¾§¹żĀĖĻ“µÓµĆµ½ĀČ»ÆĆ¾¾§Ģ壬ĀČ»ÆĒāĘųĮ÷ÖŠ¼ÓČČ·Ö½āÉś³ÉĀČ»ÆĆ¾¹ĢĢ壬µē½āĀČ»ÆĆ¾µĆµ½½šŹōĆ¾£¬äåµ„ÖŹĶØČė¶žŃõ»ÆĮņĖ®ČÜŅŗÖŠ£¬ĶØČėĀČĘųÕōĮóµĆµ½äåµ„ÖŹ£¬
£Ø1£©Ca2+ÓĆĢ¼ĖįÄĘ×Ŗ»ÆĪŖ³Įµķ”¢Mg2+ÓĆNaOH×Ŗ»ÆĪŖ³Įµķ”¢SO42-ÓĆĀČ»Æ±µČÜŅŗ×Ŗ»ÆĪŖ³Įµķ£¬Č»ŗóŌŁĄūÓĆ¹żĀĖ·½·Ø³żČ„ĖłÓŠ³Įµķ£¬±ŲŠėĻČ³żČ„Mg2+»ņSO42-£¬Č»ŗóŌŁ³żČ„Ca2+£¬¹żĀĖŗóŌŁ¼ÓŃĪĖį³żČ„¹żĮæµÄ”¢NaOHŗĶĢ¼ĖįÄĘ£»
£Ø2£©ŻĶČ”¼ĮµÄєȔ±ź×¼£ŗäåŌŚŻĶČ”¼ĮÖŠµÄČܽā¶Č“óÓŚŌŚĖ®ÖŠµÄČܽā¶Č£¬ŻĶČ”¼ĮŗĶäå²»·“Ó¦£¬ŻĶČ”¼ĮŗĶŌČܼĮ²»ÄÜ»„ČÜ£¬ŻĶČ”Ź±ĖłÓĆŅĒĘ÷ĪŖ·ÖŅŗĀ©¶·£»
£Ø3£©Cl2”¢Br2ÓėĖ®·“Ó¦“ęŌŚæÉÄę·“Ó¦£¬ĻņČÜŅŗÖŠ¼ÓČėĻ”ĮņĖįŹ±ÄÜŅÖÖĘCl2”¢Br2ÓėĖ®·“Ó¦£»
£Ø4£©¶žŃõ»ÆĮņŗĶäåÄÜ·¢ÉśŃõ»Æ»¹Ō·“Ó¦£»
£Ø5£©ä唢Ė®¶¼Ņ×±»Õō·¢£¬ĪĀ¶ČŌ½øß“Ł½ųĖ®µÄÕō·¢£¬ĪĀ¶Č¹żµĶµ¼ÖĀäå²»ÄÜĶźČ«±»Õō·¢£»
£Ø6£©Čܽā¶Č“óµÄĪļÖŹÄÜ×Ŗ»ÆĪŖČܽā¶ČŠ”µÄĪļÖŹ£»Ńõ»ÆĆ¾ČŪµć½Ļøߣ¬µē½āČŪČŚŃõ»ÆĆ¾ŗÄÄܽĻ“ó£®
½ā“š ½ā£ŗ£Ø1£©Ca2+ÓĆĢ¼ĖįÄĘ×Ŗ»ÆĪŖ³Įµķ”¢Mg2+ÓĆNaOH×Ŗ»ÆĪŖ³Įµķ”¢SO42-ÓĆĀČ»Æ±µČÜŅŗ×Ŗ»ÆĪŖ³Įµķ£¬Č»ŗóŌŁĄūÓĆ¹żĀĖ·½·Ø³żČ„ĖłÓŠ³Įµķ£¬±ŲŠėĻČ³żČ„Mg2+»ņSO42-£¬Č»ŗóŌŁ³żČ„Ca2+£¬ŅņĪŖĢ¼ĖįÄĘÖŠĢ¼ĖįøłĄė×ÓŅ×±»ŃĪĖį³żČ„£¬ĖłŅŌŌŚ ĒāŃõ»ÆÄĘ»ņĀČ»Æ±µÖ®ŗóŌŁ¼ÓĢ¼ĖįÄĘČÜŅŗ£¬¹żĀĖŗóŌŁ¼ÓŃĪĖį³żČ„¹żĮæµÄ”¢NaOHŗĶĢ¼ĖįÄĘ£¬ĖłŅŌ³żŌÓĖ³ŠņŹĒ¢Ś¢Ż¢Ü¢Ł¢Ū»ņ¢Ż¢Ś¢Ü¢Ł¢Ū£¬¹ŹŃ”ad£¬
¹Ź“š°øĪŖ£ŗad£»
£Ø2£©äåŌŚCCl4»ņ±½ÖŠµÄČܽā¶Č“óÓŚŌŚĖ®ČÜŅŗÖŠµÄČܽā¶Č£¬ÕāĮ½ÖÖĪļÖŹŗĶä嶼²»·“Ó¦£¬ŗĶĖ®²»»„ČÜ£¬ĖłŅŌєȔŻĶČ”¼ĮĪŖCCl4»ņ±½£¬ŻĶČ”Ź¹ÓĆŅĒĘ÷ĪŖ·ÖŅŗĀ©¶·£¬
¹Ź“š°øĪŖ£ŗCCl4»ņ±½£»·ÖŅŗĀ©¶·£»
£Ø3£©Cl2+H2O?HCl+HClO”¢Br2+H2O?HBr+HBrO£¬ÓĆĖįĖį»ÆŹ±£¬ČÜŅŗÖŠĒāĄė×ÓÅضČŌö“óŅÖÖĘCl2”¢Br2ÓėĖ®·“Ó¦£¬ĖłŅŌÓĆĮņĖįĖį»ÆæÉĢįøßCl2ĄūÓĆĀŹ£¬
¹Ź“š°øĪŖ£ŗĖį»ÆæÉŅÖÖĘCl2”¢Br2ÓėĖ®·“Ó¦£»
£Ø4£©äå¾ßÓŠĒæŃõ»ÆŠŌ£¬¶žŃõ»ÆĮņ¾ßÓŠ»¹ŌŠŌ£¬¶žÕßŌŚĖ®ČÜŅŗĄļ·¢ÉśŃõ»Æ»¹Ō·“Ӧɜ³ÉĮņĖįŗĶĒāäåĖį£¬Ąė×Ó·“Ó¦·½³ĢŹ½ĪŖBr2+SO2+2H2O=4H++SO42-+2Br-£¬
¹Ź“š°øĪŖ£ŗBr2+SO2+2H2O=4H++SO42-+2Br-£»
£Ø5£©ŌŚäåĖ®ÖŠ£¬äåµÄ·ŠµćŹĒ58.5”ćC£¬Ė®µÄŹĒ100”ćC£¬ĪĀ¶Č¹żøߣ¬“óĮæĖ®ÕōĘųĖęÖ®Åųö£¬äåĘųÖŠĖ®·ÖŌö¼Ó£»ĪĀ¶Č¹żµĶ£¬äå²»ÄÜĶźČ«Õō³ö£¬²śĀŹµĶ£¬
¹Ź“š°øĪŖ£ŗĪĀ¶Č¹żøߣ¬“óĮæĖ®ÕōĘųĖęÖ®Åųö£¬äåĘųÖŠĖ®·ÖŌö¼Ó£»ĪĀ¶Č¹żµĶ£¬äå²»ÄÜĶźČ«Õō³ö£¬²śĀŹµĶ£»
£Ø6£©Ca£ØOH£©2ŹōÓŚĪ¢ČÜĪļ”¢Mg£ØOH£©2ŹōÓŚÄŃČÜĪļ£¬Mg£ØOH£©2³ĮµķÖŠ»ģÓŠCa£ØOH£©2£¬ÓĆMgCl2ČÜŅŗ½ųŠŠĻ“µÓ£¬Ź¹Ca£ØOH£©2×Ŗ»ÆĪŖÄŃČÜĪļMg£ØOH£©2“Ó¶ų³żČ„Ca£ØOH£©2£»MgOČŪµćŗÜøߣ¬µē½āČŪČŚŃõ»ÆĆ¾ŠčŅŖĻūŗĽĻøßµÄÄÜĮ棬“Ó¶ųŌö¼Ó³É±¾£¬¹¤ŅµÉĻÓƵē½āČŪČŚĀČ»ÆĆ¾Ņ±Į¶Mg£¬
¹Ź“š°øĪŖ£ŗMgCl2£»²»Ķ¬Ņā£»MgOČŪµćŗÜøߣ¬ČŪČŚŹ±ŗÄÄÜøߣ¬Ōö¼ÓÉś²ś³É±¾£®
µćĘĄ ±¾Ģāæ¼²éĮĖŗ£Ė®×ŹŌ“¼°ĘäĄūÓĆ£¬Éę¼°½šŹōµÄŅ±Į¶”¢ĪļÖŹµÄ·ÖĄėŗĶĢį“攢Ńõ»Æ»¹Ō·“Ó¦µČÖŖŹ¶µć£¬ÄÜ“Ó×ÜĢåÉĻ·ÖĪö¹¤ŅÕĮ÷³ĢĶ¼£¬ÖŖµĄĆæŅ»²½·¢ÉśµÄ·“Ó¦»ņ²Ł×÷·½·Ø£¬ŹģĻ¤³£¼ūĪļÖŹµÄ·ÖĄė·½·Ø£¬×¢Ņā£Ø1£©ÖŠ³żŌÓ¼ĮµĪ¼ÓĖ³Šņ£¬ĪŖѧĻ°Ņדķµć£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ŅŃÖŖæÉÄę·“Ó¦A£Øg£©+B£Øg£©?C£Øg£©+D£Øg£©¹ż³ĢÖŠµÄÄÜĮæ£ØkJ£©±ä»ÆČēĶ¼ĖłŹ¾£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
ŅŃÖŖæÉÄę·“Ó¦A£Øg£©+B£Øg£©?C£Øg£©+D£Øg£©¹ż³ĢÖŠµÄÄÜĮæ£ØkJ£©±ä»ÆČēĶ¼ĖłŹ¾£¬»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 6.4gÓÉO3ŗĶO2×é³ÉµÄ»ģŗĻĘųĢåÖŠŅ»¶Øŗ¬ÓŠ0.4NAøöŌ×Ó | |
| B£® | ³£ĪĀ³£Ń¹ĻĀ£¬5.6gĢś·ŪŌŚ7.1gĀČĘųÖŠ³ä·ÖČ¼ÉÕ£¬Ź§Č„µÄµē×ÓŹżÄæĪŖ0.3NA | |
| C£® | ³£ĪĀĻĀ£¬pH=1µÄHNO3ČÜŅŗÖŠŗ¬ÓŠ0.1NAøöH+ | |
| D£® | 0.1mol KHSO4¾§ĢåÖŠŗ¬ÓŠµÄŃōĄė×ÓŹżŹĒ0.2NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| 1 | 2 | 3 | |
| æÕ°×ŹµŃéĻūŗÄĮņĖįīę±ź×¼ČÜŅŗµÄĢå»ż£Øml£© | 0.75 | 0.50 | 0.80 |
| 0.25æĖѳʷĻūŗÄĮņĖįīę±ź×¼ČÜŅŗµÄĢå»ż£Øml£© | 24.65 | 24.75 | 24.70 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | HCOOCH2CH2CH3 | B£® | CH3CH2COOCH3 | C£® | CH3COOCH2CH3 | D£® | HCOOCH£ØCH3£©2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŅŃÖŖN2£Øg£©+3H2£Øg£©?2NH3£Øg£©”÷H=-92.4KJ/mol£¬ŌŚøĆ·“Ó¦ÖŠ£¬µ±ÓŠ3NAµē×Ó×ŖŅĘŹ±£¬ÉĻŹöČČ»Æѧ·“Ó¦·½³ĢŹ½µÄģŹ±äĪŖ”÷H=-46.2KJ/mol | |
| B£® | 1L 0.1mol•L-1Ģ¼ĖįÄĘČÜŅŗµÄŅõĄė×Ó×ÜŹżµČÓŚ0.1NA | |
| C£® | ŹŅĪĀĻĀpH=13µÄNaOHČÜŅŗÖŠŗ¬ÓŠµÄOH-0.1NA | |
| D£® | ÅØ¶Č·Ö±šĪŖ1mol•L-1ŗĶ0.5mol•L-1µÄCH3COOHŗĶCH3COONa»ģŗĻŅŗ¹²1L£¬ŗ¬CH3COOHŗĶCH3COO-¹²1.5mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | $\frac{{V}_{m}nb}{m{N}_{A}}$ | B£® | $\frac{{V}_{m}mb}{n{N}_{A}}$ | C£® | $\frac{{V}_{m}n{N}_{A}}{mb}$ | D£® | $\frac{nb{N}_{A}}{{V}_{m}m}$ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µČĪļÖŹµÄĮæµÄĮņÕōĘųŗĶĮņ¹ĢĢå·Ö±šĶźČ«Č¼ÉÕ£¬ŗóÕ߷ųöµÄČČĮæÉŁ | |
| B£® | Óɵ„ÖŹA×Ŗ»ÆĪŖµ„ÖŹBŹ±”÷H=+119 kJ•mol-1æÉÖŖµ„ÖŹB±Čµ„ÖŹAĪČ¶Ø | |
| C£® | Ļ”ČÜŅŗÖŠ£ŗH+£Øaq£©+OH-£Øaq£©ØTH2O£Øl£©”÷H=-57.3 kJ•mol-1£¬Čō½«ŗ¬0.5 mol H2SO4µÄÅØĮņĖįÓėŗ¬1 mol NaOHµÄČÜŅŗ»ģŗĻ£¬·Å³öµÄČČĮæŠ”ÓŚ57.3 kJ | |
| D£® | ŌŚ101 kPaŹ±£¬H2Č¼ÉÕµÄČČ»Æѧ·½³ĢŹ½ĪŖ2H2£Øg£©+O2£Øg£©ØT2H2O£Øl£©”÷H=-571.6 kJ•mol-1£¬ŌņH2ŌŚ101 kPaŹ±µÄČ¼ÉÕČČĪŖ571.6 kJ•mol-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com