
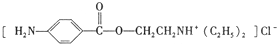 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
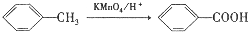
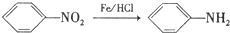

 .
. ,C中含有的含氧官能团的名称为硝基、羧基.
,C中含有的含氧官能团的名称为硝基、羧基. +HOCH2CH2N(C2H5)2$\stackrel{一定条件下}{→}$
+HOCH2CH2N(C2H5)2$\stackrel{一定条件下}{→}$ +H2O.
+H2O. (任写一种).
(任写一种).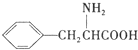 )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式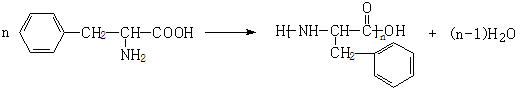 .
. 分析 乙烯发生氧化反应生成A,A的核磁共振氢谱只有一个峰,则A的结构简式为 ;D在Fe/HCl条件下发生反应生成产品,D结构简式为
;D在Fe/HCl条件下发生反应生成产品,D结构简式为 ,根据反应⑤知,C的结构简式为
,根据反应⑤知,C的结构简式为 ,B被氧化生成C,结合题给信息知,B结构简式为
,B被氧化生成C,结合题给信息知,B结构简式为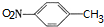 ,甲苯发生反应生成对甲基硝基苯,则反应③为取代反应,据此分析解答.
,甲苯发生反应生成对甲基硝基苯,则反应③为取代反应,据此分析解答.
解答 解:乙烯发生氧化反应生成A,A的核磁共振氢谱只有一个峰,则A的结构简式为 ;D在Fe/HCl条件下发生反应生成产品,D结构简式为
;D在Fe/HCl条件下发生反应生成产品,D结构简式为 ,根据反应⑤知,C的结构简式为
,根据反应⑤知,C的结构简式为 ,B被氧化生成C,结合题给信息知,B结构简式为
,B被氧化生成C,结合题给信息知,B结构简式为 ,甲苯发生反应生成对甲基硝基苯,则反应③为取代反应,
,甲苯发生反应生成对甲基硝基苯,则反应③为取代反应,
(1)通过以上分析知,A的结构简式为 ,故答案为:
,故答案为: ;
;
(2)C的结构简式为 ,C中含有的含氧官能团的名称为为硝基、羧基,
,C中含有的含氧官能团的名称为为硝基、羧基,
故答案为: ;硝基、羧基;
;硝基、羧基;
(3)合成路线中属于氧化反应的有①④,反应③的反应类型为取代反应,
故答案为:①④;取代反应;
(4)反应⑤的化学反应方程式为 ,
,
故答案为: ;
;
(5)B为 ,B的某种同系物E,相对分子质量比B大28,其中-NO2与苯环直接相连,符合条件的有多种,其中一种结构简式为
,B的某种同系物E,相对分子质量比B大28,其中-NO2与苯环直接相连,符合条件的有多种,其中一种结构简式为 ,
,
故答案为: ;
;
(6)E的同分异构体符合下列条件:①结构中含有一个“-NH2 ”与一个“-COOH”、②苯环上有三个各不相同的取代基,如果存在-NH2、-COOH、-CH2CH3,如果-NH2、-COOH相邻,则有四种同分异构体,如果-NH2、-COOH相间,则有四种同分异构体,如果-NH2、-COOH相对有两种同分异构体,共有10个同分异构体;
如果存在-NH2、-CH2COOH、-CH3,如果-NH2、-CH2COOH相邻有四种同分异构体,如果-NH2、-CH2COOH相间有四种同分异构体,如果-NH2、-CH2COOH相对有2种同分异构体,共有10种;
如果存在-CH2NH2、-COOH、-CH3,如果-CH2NH2、-COOH相邻有四种同分异构体,如果-CH2NH2、-COOH相间有四种同分异构体,如果-CH2NH2、-COOH相对有两种同分异构体,所以共有10种;
则符合条件的共有30种同分异构体;
故答案为:30;
(7)苯丙氨酸( )是人体必需的氨基酸之一,因为含有氨基和羧基,所以能发生缩聚反应,其发生缩聚反应的化学方程式
)是人体必需的氨基酸之一,因为含有氨基和羧基,所以能发生缩聚反应,其发生缩聚反应的化学方程式 ,
,
故答案为: .
.
点评 本题考查有机物推断,侧重考查学生分析判断、知识迁移、获取信息利用信息能力,根据产品结构、题目信息采用正逆结合的方法进行推断,难点是同分异构体种类判断,要考虑位置结构、碳链异构、官能团异构,注意氨基酸发生缩聚反应断键和成键位置,这些都是高考热点和难点.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题
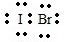 ,它是由极性共价键形成的极性分子.
,它是由极性共价键形成的极性分子.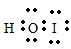 ,写出该反应的化学方程式IBr+H2O=HBr+HIO.
,写出该反应的化学方程式IBr+H2O=HBr+HIO.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在碱金属元素中,所有碱金属的氧化物均属于碱性氧化物 | |
| B. | 由于活泼性Na<K,故金属钾可以从NaCl 溶液中置换出钠单质 | |
| C. | 金属锂不能保存在煤油中,金属钾可以保存在煤油中 | |
| D. | 碱金属在自然界中都以游离态存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 所有物质之间均存在化学键 | |
| C. | 由非金属元素可以组成离子化合物 | |
| D. | 不同元素组成的多原子分子里的化学键一定为极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
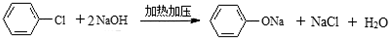

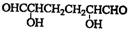 .
.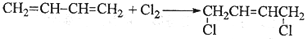 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
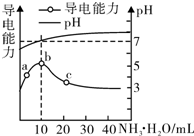
| A. | a~b点导电能力增强说明HR为弱酸 | |
| B. | b点溶液pH=7说明NH4R没有水解 | |
| C. | c点溶液存在c( NH4+)>c( R-)、c(OH-)>c(H+) | |
| D. | b~e任意点溶液均有c(H+)×c(OH-)=Kw=l.0×l0-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
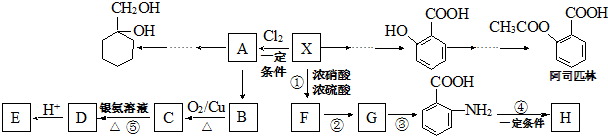
 (苯胺,易被氧化)
(苯胺,易被氧化) .
. 的同系物M比其本身相对分子质量大14,M的同分异构体中能同时满足以下条件:①芳香族化合物,②能发生水解反应,③与FeCl3溶液能够发生显色反应;共有19(不考虑立体异构)种.
的同系物M比其本身相对分子质量大14,M的同分异构体中能同时满足以下条件:①芳香族化合物,②能发生水解反应,③与FeCl3溶液能够发生显色反应;共有19(不考虑立体异构)种. 和其他无机物合成
和其他无机物合成 最合理的方案.
最合理的方案. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com