
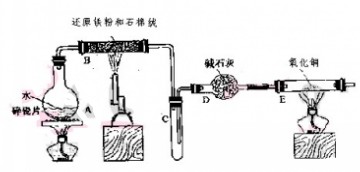
| A.稀盐酸 | B.氢氧化钠溶液 | C.浓硫酸 | D.FeCl3溶液 |

 Fe3O4 + 4H2 . 除去H2中的水蒸汽
Fe3O4 + 4H2 . 除去H2中的水蒸汽 Fe3O4 + 4H2,混有水气的氢气经碱石灰干燥后,还原CuO
Fe3O4 + 4H2,混有水气的氢气经碱石灰干燥后,还原CuO

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
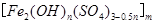 ,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:
,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下: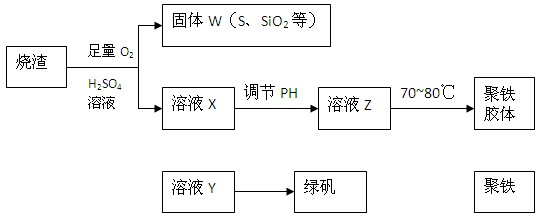
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.酸性 | B.氧化性 | C.酸性和氧化性 | D.还原性 |
 mol;
mol; ol(用含a的式子表示);
ol(用含a的式子表示); 2NaNO2+H2O
2NaNO2+H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
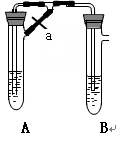
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CuSO4溶液 | B.稀HNO3溶液 | C.Fe2(SO4)3溶液 | D.Al2(SO4)3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.7:1 | B.1:7 | C.7:8 | D.8:7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
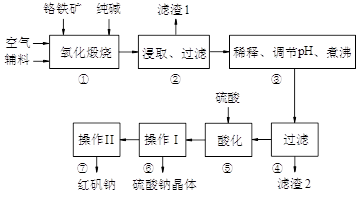
 8Na2CrO4 + 2Fe2O3 + 8CO2
8Na2CrO4 + 2Fe2O3 + 8CO2 2NaAlO2 + CO2↑等
2NaAlO2 + CO2↑等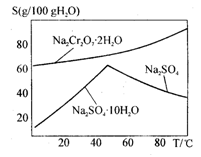
 是______(填序号)。
是______(填序号)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com