
合成气(CO和H2为主的混合气体)不但是重要的燃料也是重要的化工原料,制备合成气的方法有多种,用甲烷制备合成气的反应为:
①CH4(g)+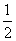 O2(g)====CO(g)+2H2(g) ΔH1=-36 kJ·mol-1
O2(g)====CO(g)+2H2(g) ΔH1=-36 kJ·mol-1
②CH4(g)+H2O(g)====CO(g)+3H2(g) ΔH2=+216 kJ·mol-1
(1)氢气与氧气反应生成水蒸气的热化学方程式为
___________________________________________________________________。
(2)现有1 mol由H2O(g)与O2组成的混合气,且O2的体积分数为x,将此混合气与足量CH4充分反应。
①若x=0.2,反应①放出的能量为________ kJ。
②若x=0.5,反应①与②______(填“放出”或“吸收”)的总能量为_____kJ。
③若x=________时,反应①与②放出(或吸收)的总能量为0。
【解析】(1)由①-②得:H2(g)+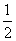 O2(g)====H2O(g) ΔH=-252 kJ·mol-1。(2)①若x=0.2,则n(O2)=0.2 mol,反应①放出的热量为0.2×
O2(g)====H2O(g) ΔH=-252 kJ·mol-1。(2)①若x=0.2,则n(O2)=0.2 mol,反应①放出的热量为0.2×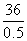 kJ=
kJ=
14.4 kJ;②若x=0.5,则n(O2)=0.5 mol,n(H2O)=0.5 mol,反应①放出的热量为36 kJ,反应②吸收的能量为0.5 mol×216 kJ·mol-1=108 kJ,反应吸收的总能量为108 kJ-36 kJ=72 kJ;③由反应①和②可知,当O2与H2O的物质的量之比为3∶1时,反应①与②放出的总能量为0。
答案:(1)2H2(g)+O2(g)====2H2O(g) ΔH=-504 kJ·mol-1
(2)①14.4 ②吸收 72 ③0.75


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
材料的不断发展可以促进社会进步.
①“玉兔”号月球车开创了我国月球表面探索的先河,其制备材料中使用了镁铝合金,选用镁铝合金的优点是 、、 (任答一点).
②碳化硅硬度很大,它属于 (填字母).
a.金属材料 b.无机非金属材料 c.有机高分子材料
③随便丢弃用过的聚乙烯塑料膜会造成白色污染,写出由乙烯在催化剂作用下制备聚乙烯的化学方程式 .

查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验装置设计正确且能达到目的的是
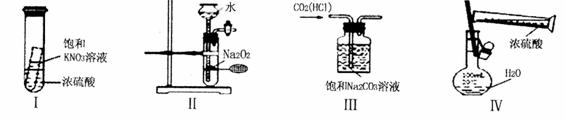
A.实验I:静置一段时间,小试管内有晶体析出 B. 实验II:制取氧气
C. 实验III除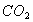 气体中的HCL D.实验IV:配制一定物质的量浓度的稀硫酸
气体中的HCL D.实验IV:配制一定物质的量浓度的稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
三颈瓶在化学实验中的应用非常广泛,下面是三颈瓶在部分无机实验或有机实验中的一些应用。
(1)在如图所示装置中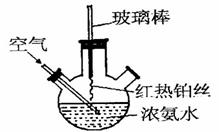 ,进行氨的催化氧化实验:向三颈瓶内的浓氨水中不断通入空气,将红热的铂丝插入瓶子并接近液面。反应过程中可观察到瓶中有红棕色气体产生,铂丝始终保持红热。实验过程中
,进行氨的催化氧化实验:向三颈瓶内的浓氨水中不断通入空气,将红热的铂丝插入瓶子并接近液面。反应过程中可观察到瓶中有红棕色气体产生,铂丝始终保持红热。实验过程中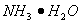 的电离程度____(填“变大”、“变小”或“不变”)
的电离程度____(填“变大”、“变小”或“不变”)
(2)实验室用下图所示装置制备氨基甲酸铵(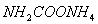 ),其反应化学方程式:
),其反应化学方程式:
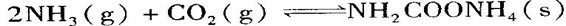
该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
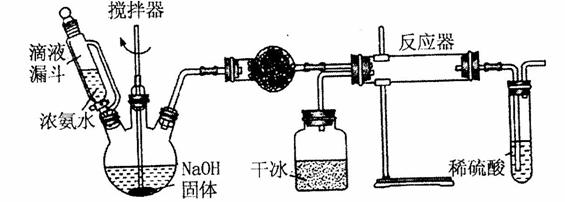
①写出加入药品之前实验操作的要点_______;反应中若有水存在则生成碳酸氢铵的化学方程式是________________________。
②干燥管中盛放的药品是______。简述左侧三颈瓶装置制取氨气的原理________。
③对比碳酸盐和酸的反应制取 ,该实验利用干冰升华产生
,该实验利用干冰升华产生 气体的有优点有_____.
气体的有优点有_____.
④有同学认为该实验装置存在安全问题,请问可能面临的安全问题是________。
⑤氨基甲酸氨可用作肥料,其肥效比尿素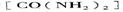 _______(填“高”或“低”),在潮湿的空气中释放出氨而变成碳酸氢铵。取因部分变质二混有碳酸氢铵的氨基甲酸铵样品0.7830g,用足量石灰水充分处理后,使样品中碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g,则样品中氨基甲酸铵的物质的量分数是_____________。
_______(填“高”或“低”),在潮湿的空气中释放出氨而变成碳酸氢铵。取因部分变质二混有碳酸氢铵的氨基甲酸铵样品0.7830g,用足量石灰水充分处理后,使样品中碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g,则样品中氨基甲酸铵的物质的量分数是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
①H2O(g)====H2O(l) ΔH=- Q 1 kJ·mol-1
②C2H5OH(g)====C2H5OH(l) ΔH=- Q 2 kJ·mol-1
③C2H5OH(g)+3O2(g)====2CO2(g)+3H2O(g) ΔH=-Q3 kJ·mol-1
下列判断正确的是( )
A.酒精的燃烧热为Q3 kJ
B.若使23 g液态酒精完全燃烧,最后恢复到室温,释放出的热量为(1.5Q1-0.5Q2+0.5Q3) kJ
C.H2O(g)→H2O(l)释放出了热量,所以该过程为化学变化
D.由反应③可知1 mol C2H5OH(g)的能量高于2CO2(g)和3H2O(g)的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO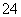
B.甲基橙呈红色的溶液:NH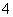 、Ba2+、AlO
、Ba2+、AlO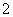 、Cl-
、Cl-
C.与铝反应产生大量氢气的溶液:Na+、K+、CO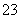 、Cl-
、Cl-
D.pH=12的溶液:K+、Na+、CH3COO-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关元素周期表的说法不正确的是 ( )
A.第15列某元素能与其他元素化合形成碱性气体
B.第2列元素中肯定没有非金属元素
C.第17列的第一种元素的原子序数为9
D.短周期中能与强碱反应产生H2的金属元素位于第ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是( )
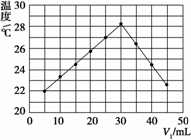
A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00 mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336 mL (标准状况)气体。回答:
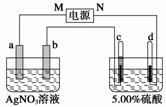
(1)直流电源中,M为__________极。
(2)Pt电极上生成的物质是________,其质量为__________________________g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为2∶______∶______∶________。
(4)AgNO3溶液的浓度________(填“增大”、“减小”或“不变”,下同),AgNO3溶液的pH______,硫酸的浓度__________________________,硫酸的pH________。
(5)若硫酸的质量分数由5.00%变为5.02%,则原有5.00%的硫酸________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com