



 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
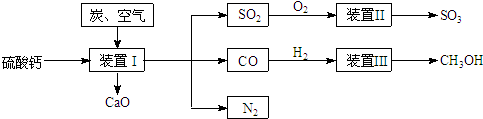
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ����x��ʱ��/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
| һ������ |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�꽭��ʦ���С�ӥ̶һ�и�������������ѧ�Ծ��������棩 ���ͣ�������
̼���仯�����й㷺����;��
��1����ˮ����ͨ�����ȵ�̼���ɲ���ˮú������ӦΪ��
C(s)�� H2O(g) 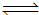 CO(g)
��H2(g) ��H=
+131.3 kJ•mol-1�����Ϸ�Ӧ�ﵽƽ������������������£����´�ʩ���������H2O��ƽ��ת���ʵ���
��(�����)
CO(g)
��H2(g) ��H=
+131.3 kJ•mol-1�����Ϸ�Ӧ�ﵽƽ������������������£����´�ʩ���������H2O��ƽ��ת���ʵ���
��(�����)
A�������¶ȡ� B������̼������ C�������������D����CO���ռ���ȥCO
��2����֪��C��s��+ CO2��g��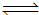 2CO��g��
��H=+172.5kJ•mol-1
2CO��g��
��H=+172.5kJ•mol-1
��CO��g��+H2O��g��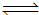 CO2��g��+H2��g�����ʱ��H=
CO2��g��+H2��g�����ʱ��H=
��3��CO��H2��һ�������¿ɷ�Ӧ���ɼ״���CO��g��+2H2��g��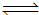 CH3OH��g�����״���һ��ȼ�ϣ������ü״����һ��ȼ�ϵ�أ���ϡ�������������Һ�����ʯī���缫���õ�ظ�����ӦʽΪ��
��
CH3OH��g�����״���һ��ȼ�ϣ������ü״����һ��ȼ�ϵ�أ���ϡ�������������Һ�����ʯī���缫���õ�ظ�����ӦʽΪ��
��
���øõ���ṩ�ĵ��ܵ��60mL NaCl��Һ������0.01molCH3OH��ȫ�ŵ磬NaCl�������ҵ�������Cl2ȫ����������ǰ�������Һ����ı仯�����������������Һ��pH=
��4����һ������CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2.0L�ĺ����ܱ������У��������·�Ӧ��
 CO(g)��H2O(g)
CO2(g)��H2(g)���õ��������ݣ�
CO(g)��H2O(g)
CO2(g)��H2(g)���õ��������ݣ�
|
�¶�/�� |
��ʼ��/mol |
ƽ����/mol[ѧ�� |
�ﵽƽ����x��ʱ��/min |
||
|
H2O |
CO |
H2 |
CO |
||
|
900 |
1.0 |
2.0 |
0.4 |
1.6 |
3.0 |
ͨ����������÷�Ӧ��ƽ�ⳣ��(���������λ��Ч����) ����������������������
�ı䷴Ӧ��ijһ��������Ӧ���е�tminʱ����û��������CO2�����ʵ���Ϊ0.6 mol������200 mL 5 mol/L��NaOH��Һ������ȫ���գ���Ӧ�����ӷ���ʽΪ����һ�����ӷ���ʽ��ʾ����������������������������������������������
��5����ҵ�����ǰ�ˮú���еĻ�����徭���������õĽϴ�H2���ںϳɰ����ϳɰ���Ӧԭ��Ϊ��N2(g)+3H2(g)
 2NH3(g)
��H��-92.4kJ•mol-1��ʵ����ģ�⻯���������ֱ��ڲ�ͬʵ�������·�Ӧ��N2Ũ����ʱ��仯����ͼ��
2NH3(g)
��H��-92.4kJ•mol-1��ʵ����ģ�⻯���������ֱ��ڲ�ͬʵ�������·�Ӧ��N2Ũ����ʱ��仯����ͼ��
��ͬʵ�������·�Ӧ��N2Ũ����ʱ��仯����ͼ1��


ͼ1 ͼ2
��ش��������⣺
����ʵ���Ƚϣ�ʵ���ı������Ϊ ��
��ʵ����ʵ�����¶�Ҫ�ߣ�����������ͬ��������ͼ2�л���ʵ����ʵ�����NH3Ũ����ʱ��仯��ʾ��ͼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ģ���� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��ģ���� ���ͣ������
 CaCO3
CaCO3  2MgO+C
2MgO+C 
 CH3OH(g)��ij�о�С�齫2 mol
CH3OH(g)��ij�о�С�齫2 mol 
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com