
氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92kJ·mol-1
2NH3(g) ΔH=-92kJ·mol-1
请回答下列问题:
(1)取1 mol N2(g)和3 molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量 92kJ(填“大于”、“等于”或“小于”), 原因是
;若加入催化剂,ΔH (填“变大”、“变小”或“不变”)。
(2)下列有关合成氨反应速率的叙述,不正确的是 (选填序号)。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,但可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
e.温度升高,其平衡常数数值变小
(3)已知:分别破坏1mol N![]() N键、1mol H
N键、1mol H![]() H键需要吸收的能量为:946 kJ、436 kJ,则破坏1mol N
H键需要吸收的能量为:946 kJ、436 kJ,则破坏1mol N![]() H键需要吸收的能量为 kJ。
H键需要吸收的能量为 kJ。
(4)N2H4可视为:NH3分子中的H被-NH2取代的产物。
发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7 kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ/mol。
则:1mol N2H4完全反应的热化学方程式为 。
科目:高中化学 来源: 题型:阅读理解
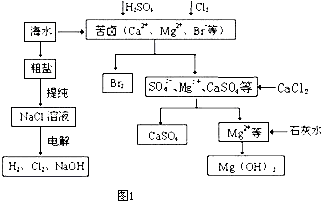
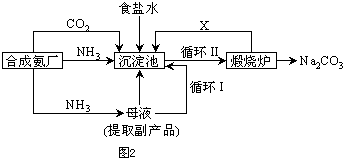
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:福建省上杭一中2010-2011学年高二下学期期中考试化学试题 题型:022
氮是地球上极为丰富的元素.填写下列空白.
(1)NH![]() 中N原子的杂化轨道类型为________,
中N原子的杂化轨道类型为________,
NH![]() 的空间构型为________.
的空间构型为________.
(2)常温下,锂可与氮气直接反应生成Li3N,Li3N晶体中氮以N3-存在,基态N3-的电子排布式为:________,Li3N晶体属于________晶体(填晶体类型).
(3)NH3的沸点为234K,NF3的沸点为154K,两者结构相似,NH3的沸点高于NF3的原因是:________.
(4)CO与N2相似,分子中都存在一个共价叁键,CO含________个π键.下表为CO与N2的相关信息.根据表中数据,说明CO比N2活泼的原因:________.

(5)根据下表数据,写出氮气与氢气反应生成氨气的热化学方程式________.
![]()
(6)CO与N2互为等电子体,其碳原子上有一对孤对电子,因此可作配体,如:Fe(CO)5、Ni(CO)4、Cr(CO)6等,在合成氨工业上中用铜洗液吸收CO,反应如下:

①基态Fe原子的未成对电子数有________个,
写出Cr、Cu+的价层电子排布式.________、________.
②醋酸二氨合铜(I)和醋酸羰基三氨合铜(I)都是配合物,[Cu(NH3)3CO]+中提供孤对电子的分子是:________,接受孤对电子的离子是:________,用箭号标出[Cu(NH3)2]+形成的配位键:________,[Cu(NH3)2]+中两个配位键的键角为180°,则Cu+采取________杂化与NH3形成配位键(填杂化类型).
③Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂.推测Ni(CO)4是________分子(填“极性”或“非极性”).
(7)氮化硅是一种高温陶瓷材料,它硬度大、熔点高、化学性质稳定.
①氮化硅晶体属于________晶体(填晶体类型);
②已知氮化硅晶体结构中,原子间都以共价键相连,且N原子与N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子结构,请写出氮化硅的化学式:________.
(8)极纯的氮气可由叠氮化钠(NaN3)加热分解而得到.2NaN3(s)=2Na(l)+3N2(g),反应过程中,断裂的化学键是离子键和共价键,形成的化学键有________.
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用。请回答下列问题:
(1)用CH4催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g)+ 2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) = 2 N2(g)+CO2(g)+ 2H2O(g) ΔH2、
若1mol CH4 还原NO2 至N2,整个过程中放出的热量为867 kJ,则ΔH2= ;
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H22NH3 ,则在电化学合成氨的过程中,阴极反应式为 ;
(3)在一定条件下,将l mol N2 与3 mol H2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:
①A点时N2的浓度为 mol/L;
②右图中在状态A时,平衡常数 KA = (填写代入数值的表达式,不要求化简);当温度由T1变化到T2时,KA KB(填“>”、“<”或“=”)。
③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
| 时间/min 浓度/mol•L—1 | c (N2) | c (H2) | c (NH3) |
| 0 | 0.6 | 1.8 | 0 |
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |
反应从0 min到3 min之间,H2的反应速率为 ;反应在3 min时,条件发生了改变,改变的条件可能是 (填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度 d.充入Ne增大压强
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省高三第五次质量检测考试理科综合试卷(化学部分) 题型:填空题
(14分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) = 2 N2(g)+CO2(g) + 2H2O(g) ΔH2、
若1 mol CH4 还原NO2 至N2,整个过程中放出的热量为867 kJ,则ΔH2= ;
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2 2NH3 ,则在电化学合成氨的过程中,阴极反应式为
;
2NH3 ,则在电化学合成氨的过程中,阴极反应式为
;
(3)在一定条件下,将l mol N2 与3 mol H2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:

①A点时N2的浓度为 mol/L;
②右图中在状态A时,平衡常数 KA = (填写代入数值的表达式,不要求化简);当温度由T1变化到T2时,KA KB(填“>”、“<”或“=”)。
③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
|
时间/min 浓度/mol•L—1 |
c (N2) |
c (H2) |
c (NH3) |
|
0 |
0.6 |
1.8 |
0 |
|
3 |
0.52 |
x |
0.16 |
|
6 |
0.36 |
1.08 |
0.48 |
|
9 |
0.36 |
1.08 |
0.48 |
反应从0 min到3 min之间,H2的反应速率为 ;反应在3 min时,条件发生了改变,改变的条件可能是 (填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度 d.充入Ne增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com