
| A. | 长颈漏斗 | B. | 分液漏斗 | C. | 圆底烧瓶 | D. | 蒸馏烧瓶 |
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应中SO2不能全部转化为SO3 | |
| B. | 无限增加反应时间,SO2能全部转化为SO3 | |
| C. | 达到化学平衡时,反应混合物中同时存在SO2、O2、SO3 | |
| D. | 达到化学平衡时,SO3的生成速率等于SO3的分解速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+H2SO4(浓) | B. | FeO+H2SO4(浓) | C. | Ba(OH)2+H2SO4 | D. | C+H2SO4(浓) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 江河入海口三角洲的形成通常与胶体的性质有关 | |
| B. | 明矾净水过程中涉及化学变化 | |
| C. | Fe(OH)3胶体与食盐溶液混合将产生聚沉观象 | |
| D. | 沸水中滴加适量饱和FeCl3溶液,可形成带正电荷的胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
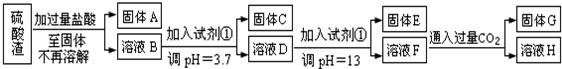
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com