
����Ŀ������Ͻ������������������������30%SiO2��40.8% Al2O3���������� Fe2O3�����ɷ���ȡ�úϽ�Ĺ������£�
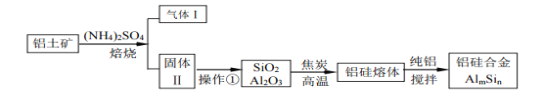
��1������Ͻ���������������Ӱ���俹��ʴ���ܣ�ԭ����_____________________
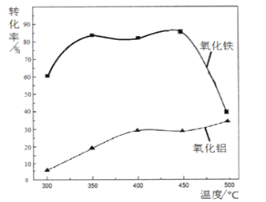
��2�����ճ�����Ӧʱ��Fe2O3ת��ΪNH4Fe��SO4 ��2��Al2O3 �ٲ��ַ������Ʒ�Ӧ��д��Fe2O3��Ӧ�Ļ�ѧ����ʽ��_____________________��������ת��Ϊ�����εİٷ������¶ȵĹ�ϵ��ͼ�������˵ı����¶���________________
��3�������������õ���Һ�м��������NaOH��Һ�����������������ӷ�Ӧ����ʽ�ǣ�_______________________��
��4���ý�̿��ԭSiO2��Al2O3�����SiC���м��塣д���м���SiC����Al2O3���ɹ衢�����ʵĻ�ѧ��Ӧ����ʽ��_________________________��
��5����֪25�� Ksp[Al��OH��3]=1.0��10-33 , Ksp[Fe��OH��3]=4.0��10-38,��FeCl3��AlCl3�Ļ����Һ����ε���NaOH��Һ������Al��OH��3��Fe��OH��3 �����������ֳ�������ʱ���ϲ���Һ��c��Al3+����c��Fe3+��==___________��
���𰸡���1������������ԭ��أ��ӿ����ĸ�ʴ��
��2��4��NH4��2SO4��Fe2O3![]() 2NH3Fe��SO4��2��3H2O��6NH3����350����
2NH3Fe��SO4��2��3H2O��6NH3����350����
��3��Al3����4OH��=AlO2����2H2O��
��4��3SiC��Al2O3![]() 3Si��2Al��3CO����5��2.5��104��
3Si��2Al��3CO����5��2.5��104��
��������
�����������1�����������ã�����ԭ��أ����������������������ӿ����ĸ�ʴ���ʣ���2��Fe2O3��NH4Fe��SO4��2�����ϼ�û�����仯����˲�����������NH3����˷�Ӧ��Ӧ����ʽΪ��4��NH4��2SO4��Fe2O3![]() 2NH3Fe��SO4��2��3H2O��6NH3����������Ϣ�Ʊ�����Ͻ������������ʣ����ѡ��������ת���ʸߣ�������ת���ʽϵ͵��¶ȣ���350������3��������Ϣ������Ҳ�ܷ��������������ķ�Ӧ��������NH4Al��SO4��2�����������������ԣ����������NaOH�������ķ�Ӧ��Al3����4OH��=AlO2����2H2O����4��C��SiO2������Ӧ����CO���Լ���Ŀ������Ϣ��������Ӧ��3SiC��Al2O3
2NH3Fe��SO4��2��3H2O��6NH3����������Ϣ�Ʊ�����Ͻ������������ʣ����ѡ��������ת���ʸߣ�������ת���ʽϵ͵��¶ȣ���350������3��������Ϣ������Ҳ�ܷ��������������ķ�Ӧ��������NH4Al��SO4��2�����������������ԣ����������NaOH�������ķ�Ӧ��Al3����4OH��=AlO2����2H2O����4��C��SiO2������Ӧ����CO���Լ���Ŀ������Ϣ��������Ӧ��3SiC��Al2O3![]() 3Si��2Al��3CO����5������Ksp[Al��OH��3]=c��Al3������c3��OH������Ksp[Fe��OH��3]=c��Fe3��3������c3��OH������ʽ��ȵõ���c��Al3����/c��Fe3����=Ksp[Al��OH��3]/Ksp[Fe��OH��3]=2.5��104��
3Si��2Al��3CO����5������Ksp[Al��OH��3]=c��Al3������c3��OH������Ksp[Fe��OH��3]=c��Fe3��3������c3��OH������ʽ��ȵõ���c��Al3����/c��Fe3����=Ksp[Al��OH��3]/Ksp[Fe��OH��3]=2.5��104��


 �żӾ���ϵ�д�
�żӾ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Ҫ������������
A�������ڿ�����ȼ�� B��̼������ȷֽ�
C��þ���������� D��Ũ��������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���ܱ������У��������з�Ӧ��CO2(g)��C(s)![]() 2CO(g) ��H>0���ﵽƽ��ı�������������ָ�����ʵ�Ũ�ȼ�ƽ�������仯��
2CO(g) ��H>0���ﵽƽ��ı�������������ָ�����ʵ�Ũ�ȼ�ƽ�������仯��
��1������C��ƽ��__________��c(CO)__________��
��2����С�ܱ��������ݻ��������¶Ȳ��䣬��ƽ��__________��c(CO2)__________��
��3��ͨ��N2�������ܱ��������ݻ����¶Ȳ��䣬��ƽ��__________��c(CO2)__________��
��4�������ܱ��������ݻ����䣬�����¶ȣ���ƽ��__________��c(CO)__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(��Ҫ�ɷ�ΪAl2O3,������������)����ȡ��������ԭ�ϡ���ȡ�������Ĺ�����������:

��1���������ӷ���ʽ��ʾ���Ϲ��������еڢٲ���Ӧ:___________________ ��
��2��д�����Ϲ��������еڢ۲���Ӧ�Ļ�ѧ����ʽ:______________________��
��3������������������ϵ�ȼ,�ᷢ�����ҵķ�Ӧ���÷�Ӧ�Ļ�ѧ����ʽ _____________�����һ���÷�Ӧ����;______________________��
��4�����������������ȡ������,����0.6 mol���ӷ���ת��,�������ܵõ��������������� _____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����þ��Ͷ��ʢ������ij���������, ����H2�����ʿ�����ͼ��ʾ��Ӱ�����������Ӧ���ʵ�������( )

�������Ũ�� ��þ���ı���� ����Һ���¶� ��Cl-��Ũ��
A���٢� B���ۢ� C���ڢ� D���٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����( )
A����ϩ�ͱ�����ʹ��ˮ��ɫ����ɫ��ԭ����ͬ
B���Ҵ������ᡢ�����������ܷ���ȡ����Ӧ
C�����ۡ���֬�������ʵ�ˮ����ﻥΪͬ���칹��
D����ά�ء�����ϩ�����ά�����ڸ߷��ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������˵����ȷ���ǣ� ��
A. ��ѧ��ɰ������ᡢ�������������
B. ��һ����������
C. ���������Ҫ�Ŵ�����
D. ÿһ�ֶ����������ض��ļ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� �о�̼���仯������ת������Դ�ij�����á���̼����������Ҫ�����á�
����֪����CH4(g)+H2O(g)![]() CO(g)+3H2(g) ��H1=+206.1kJ��mol��1
CO(g)+3H2(g) ��H1=+206.1kJ��mol��1
��2H2(g)+CO(g)![]() CH3OH(l) ��H2=��128.3kJ��mol��1
CH3OH(l) ��H2=��128.3kJ��mol��1
��2H2(g)+O2(g)![]() 2H2O(g) ��H3=��483.6kJ��mol��1
2H2O(g) ��H3=��483.6kJ��mol��1
25��ʱ���ں��ʵĴ��������£����ü��������һ���ϳ�Һ̬�״����Ȼ�ѧ����ʽΪ ��
�����÷�Ӧ�����Ʊ�������Ϊ��̽���¶ȡ�ѹǿ�Է�Ӧ�����ʡ�ת���ʵ�Ӱ�죬ijͬѧ�������������Ա�ʵ��(�¶�Ϊ400����500����ѹǿΪ101kPa��404kPa)��
ʵ����� | �¶��� | ѹǿ/kPa | CH4��ʼŨ��/ mol��L��1 | H2O��ʼŨ��/ mol��L��1 |
1 | 400 | p | 3.0 | 7.0 |
2 | t | 101 | 3.0 | 7.0 |
3 | 400 | 101 | 3.0 | 7.0 |
��ʵ��2��ʵ��3��ȣ���ƽ�ⳣ����ϵ��K2 K3(��������������������=��)��
���������ʵ�����CH4��ˮ��������1L�����ܱ������У�����������Ӧ����400���´ﵽƽ�⣬ƽ�ⳣ��K=27����ʱ������CO���ʵ���Ϊ0.10mol����CH4��ת����Ϊ ��
�� ��ѧ�������CO2�� ȡ C��̫���ܹ�����ͼ1��ʾ��
��������ϵͳ�����ķ�Ӧ��n(FeO):n(CO2)=6:1����Fe xOy�Ļ�ѧʽΪ______________��
�ڡ��ȷֽ�ϵͳ����ÿ�ֽ�l mol Fe xOy��ת�Ƶ��ӵ����ʵ���Ϊ___________��


ͼ1 ͼ2
��pC����pH����ָ��ϡ��Һ�е�����Ũ�ȵij��ø�����ֵ����ij��Һ�����ʵ�Ũ��Ϊ1��10��3mol��L��1�������Һ�����ʵ�pC����lg(1��10��3)��3����ͼ2Ϊ25��ʱH2CO3��Һ��pC��pHͼ����ش��������� (������Ũ��С��10��5mol/L������Ϊ�����Ӳ�����)��
����ͬһ��Һ�У�H2CO3��HCO3����CO32��____________(������������������)�������档
����H2CO3һ������ƽ�ⳣ������ֵKa1=________________��
������ѪҺ����Ҫͨ��̼�����λ�����ϵ![]() ���Ե����������ά��pH=7.4���������������ѪҺ��ʱ��ѪҺ������ϵ�е�
���Ե����������ά��pH=7.4���������������ѪҺ��ʱ��ѪҺ������ϵ�е�![]() ���ս�_________��
���ս�_________��
A����� B����С C���������� D�����ж�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com