
| A. | 据反应①可知N2的燃烧热为180 kJ•mol-1 | |
| B. | 2H2O(l)═2H2(g)+O2(g)△H>+483.6 kJ•mol-1 | |
| C. | 反应②在恒温恒容密闭容器反应达平衡后,充入N2,平衡正向移动,氮气的转化率减小,该反应的平衡常数增加 | |
| D. | 可推知,氨的催化氧化的热化学方程式为4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=-906 kJ•mol-1 |
分析 A、燃烧热是1mol可燃物完全燃烧是稳定氧化物放出的热量,氮气和氧气生成的一氧化氮不是稳定氧化物,会和氧气反应生成二氧化氮;
B、热化学方程式改变方向,焓变符合随之改变,液态水变化为气态水吸热,焓变比较大小包含负号;
C、平衡常数随温度变化,不随浓度变化;
D、结合热化学方程式和盖斯定律计算所得热化学方程式是否正确.
解答 解:A、燃烧热是1mol可燃物完全燃烧是稳定氧化物放出的热量,氮气和氧气生成的一氧化氮不是稳定氧化物,会和氧气反应生成二氧化氮,变化符合燃烧热概念,故A错误;
B、热化学方程式改变方向,焓变符合随之改变,液态水变化为气态水吸热,2H2(g)+O2(g)═2H2O(g)△H3=-483.6kJ•mol-1,2H2O(g)═2H2(g)+O2(g)△H=+483.6 kJ•mol-1,若变化为液态水数值大于483.6 kJ•mol-1,△H>+483.6 kJ•mol-1,故B正确;
C、反应②在恒温恒容密闭容器反应达平衡后,充入N2,平衡正向移动,平衡常数不变,故C错误;
D、①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol-1
②N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H3=-483.6kJ•mol-1
盖斯定律计算Ⅰ×2+Ⅲ×3-Ⅱ×2得到4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-906 kJ•mol-1,水为气体,故D错误;
故选B.
点评 本题考查热化学方程式的书写,燃烧热概念理解应用,掌握基础是解题关键,题目较简单.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:解答题
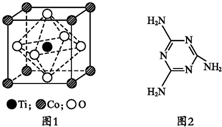 MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.
MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
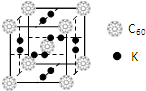 氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.
氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由紫色变为无色 | B. | 颜色无明显变化 | C. | 先褪色,后复原 | D. | 由紫色变为红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的燃烧热为Q1 kJ/mol | |
| B. | 2 mol CO(g)所具有的能量一定高于2 mol CO2(g)所具有的能量 | |
| C. | 一定质量的C燃烧,生成CO2(g)比生成CO(g)时放出的热量多 | |
| D. | C燃烧生成CO2气体的热化学方程式为:C(s)+O2(g)═CO2(g)△H=-(Q1+Q2) kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
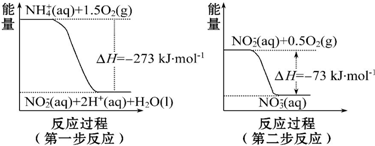
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
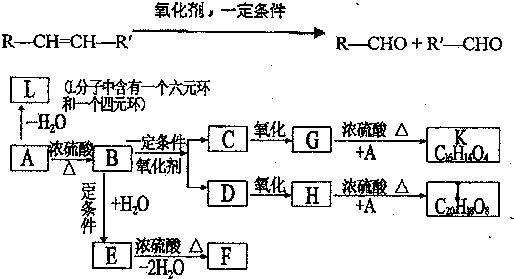
 、K
、K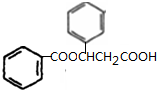 ;
; $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$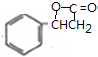 +H2O,反应类型取代反应或酯化反应;
+H2O,反应类型取代反应或酯化反应;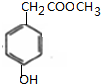 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在周期表中处于第三周期ⅦA族 | B. | 在周期表中处于第2周期ⅤA族 | ||
| C. | 氢化物比H2O稳定 | D. | 常见化合价只有-3、+2、+3、+5价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com