
| A. | ②④⑤⑥ | B. | ①④⑥ | C. | ①②④⑥ | D. | ①③④⑤ |
分析 可逆反应A(g)+3B(g)?2C(g)为气体体积缩小的反应,该反应达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,由此衍生的一些物理量不发生变化,据此进行解答.
解答 解:①C的生成速率与C的分解速率相等,说明正逆反应速率相等,达到了平衡状态,故①正确;
②单位时间内a mol A生成是逆反应,同时3a molB是逆反应,未体现正与逆的关系,故②错误;
③密度=$\frac{m}{V}$,气体的总质量会变,容器容积不变,则密度始终不变,气体密度不再变化不能作为判断是否达到平衡状态的依据,故③错误;
④反应前后气体的体积不等,混合气体的总压强不再变化可作为判断是否达到化学平衡状态的依据,故④正确;
⑤平衡时各物质的物质的量之比取决于物质的起始物质的量和转化率,则A、B、C的物质的量比为1:3:2不能作为判断是否达到平衡状态的依据,故⑤错误;
⑥反应前后都是气体,气体的总质量不变,而气体的总物质的量发生变化,则混合气体的平均相对分子质量不变时表明正逆反应速率相等,该反应达到平衡状态,故⑥正确;
故选B.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,③为易错点,注意反应前后气体的密度始终不变,试题有利于提高学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 食用白糖的主要成分是葡萄糖 | |
| B. | 淀粉溶液和蛋白质溶液都有丁达尔效应 | |
| C. | 油脂、淀粉和纤维素都是人体的重要营养物质 | |
| D. | 植物油的主要成分是高级脂肪酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
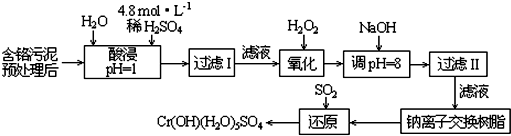
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①③ | B. | 仅②④ | C. | 仅⑤ | D. | 仅③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 稀硫酸与氢氧化钡溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 将大理石投入到足量盐酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 将Cl2与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 碳酸钠溶液显碱性:CO32-+H2O?HCO3-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
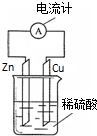
| A. | 电子由铜片通过导线流向锌片 | B. | 锌片是正极,铜片上有气泡产生 | ||
| C. | 锌片逐渐溶解 | D. | 该装置能将电能转变为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
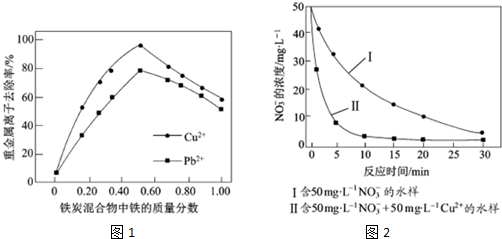
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3H2O能大量共存 |
| C | 将可调高度的铜丝伸入到稀NHO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,震荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+<I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com