
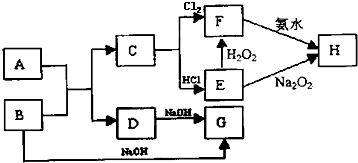
分析 已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体推断H为Fe(OH)3,C+Cl2→F,判断F为FeCl3,C为Fe,E和过氧化氢反应生成F,说明E为FeCl2,转化关系中的B、D都和氢氧化钠反应,A+B=C+D是金属置换铁的置换反应,判断为B为Al,A为Fe2O3,D为Al2O3,G为NaAlO2,结合对应物质的性质以及题目要求解答该题.
解答 解:已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体推断H为Fe(OH)3,C+Cl2→F,判断F为FeCl3,C为Fe,E和过氧化氢反应生成F,说明E为FeCl2,转化关系中的B、D都和氢氧化钠反应,A+B=C+D是金属置换铁的置换反应,判断为A为Al,B为Fe2O3,D为Al2O3,G为NaAlO2,
(1)胶体粒子直径介于1~100nm,
故答案为:1~100nm;
(2)D为Al2O3,为两性氧化物,
故答案为:两性;
(3)①A+B→C+D为铝热反应,反应的方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ Al2O3+2Fe,②D为Al2O3,D与氢氧化钠反应生成偏铝酸钠,反应的离子方程式为Al2O3+2OH-+3H2O=2[Al(OH)4]-,
故答案为:①2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ Al2O3+2Fe;②Al2O3+2OH-+3H2O=2[Al(OH)4]-;
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)E为氯化亚铁,在空气中能被空气氧化,所以实验室保存E溶液应采取的具体措施为加铁屑或铁粉,
故答案为:加铁屑或铁粉;
点评 本题以元素化合物的推断为载体考查了元素化合物的性质,通过元素化合物的推断考查学生的推理、分析、判断等能力,正确推断元素化合物是解本题的关键,题目难度中等.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铊是易导电的银白色金属 | B. | 能生成+3价离子 | ||
| C. | 氢氧化铊是两性氢氧化物 | D. | Tl3+的氧化能力比Al3+弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol CO2中含有原子数NA | |
| B. | 1mol/L的硫酸钠溶液中,所含Na+数为2NA | |
| C. | 标准状况下,11.2 L水所含分子数为0.5 NA | |
| D. | 1 mol Fe和足量盐酸完全反应失去的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20 mol | B. | 10 mol | C. | 5 mol | D. | 30 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com