
| A. | ④>②>③>① | B. | ①>④>②>③ | C. | ①>②>③>④ | D. | ④>①>③>② |
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| B. | 新制氯水中:Cl2+H2O?2H++ClO-+Cl- | |
| C. | 200 mL 2 mol/L的FeBr2溶液中通入11.2L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| D. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
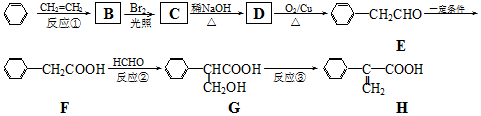
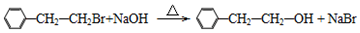 .
.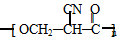 (要重新写过) 的合成路线:NCCH2CHO$→_{△}^{新制Cu(OH)_{2}}$ $\stackrel{H+}{→}$
(要重新写过) 的合成路线:NCCH2CHO$→_{△}^{新制Cu(OH)_{2}}$ $\stackrel{H+}{→}$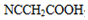 →
→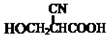 →
→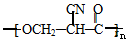 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,水电离出的c(H+)=1×10-12 mol/L的溶液中不可能大量存在:Al3+、NH4+、Cl-、S2- | |
| B. | 加入铝粉能产生H2的溶液中可能大量存在:Na+、Cl-、S2-、SO32- | |
| C. | 过量铁粉与稀HNO3反应:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | 向AlCl3溶液中滴入大量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
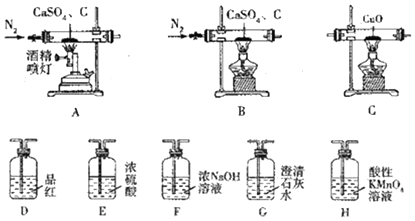
| 实验前 | 实验后 | |
| 实验1 | 装置C硬质玻璃管连同CuO质量为26.80g | 装置C硬质玻璃管连同反应后固体质量为26.64g |
| 实验2 | 装置G连同溶液质量为187.50g | 装置G连同反应后溶液及沉淀的质量为188.38g |
| 实验3 | 装置D、H连同溶液质量和为373.60g | 装置D、H连同溶液质量和为374.24g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中,KMnO4是还原剂 | |
| B. | 该反应中,C元素被氧化 | |
| C. | 通过该反应可知,氧化性:KMnO4>CO2 | |
| D. | 该反应每转移1mol电子,同时生成1molCO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com