
根据元素周期表和元素周期律分析下面的推断,其中错误的是( )
A.氯气与氢气化合比溴与氢气化合容易 B.硒化氢比硫化氢稳定
C.氢氧化锶比氢氧化钙的碱性强 D.铍的原子失电子能力比镁弱
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源:2015-2016学年天津市高一下期中化学试卷(解析版) 题型:选择题
少量铁片与100mL0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加KNO3溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
A.①⑥⑦ B.③⑤⑧ C.③⑦⑧ D.③④⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期中化学试卷(解析版) 题型:选择题
根据元素周期表和元素周期律分析下面的推断,其中错误的是
A.铍(Be)的原子失电子能力比镁弱
B.砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸
C.氢氧化锶[Sr(OH)2]比氢氧化钙的碱性强
D.硒(Se)化氢比硫化氢稳定
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏育才中学高一下期中化学试卷(解析版) 题型:选择题
下列关于充电电池的叙述,不正确的是 ( )
A.充电电池可以通过放电、充电实现化学能和电能的相互转化
B.放电时负极发生氧化反应,充电时该电极上有物质发生得电子的反应
C.现代技术使得电池设计比较先进,电池废弃后不必再进行无毒化处理
D.充电电池的化学反应原理是氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏育才中学高一下期中化学试卷(解析版) 题型:选择题
短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列推断正确的是( )
A.原子半径:W>X>Z>Y B.热稳定性:H2Y>HZ
C.离子半径:W2+>Y2- D.碱性:XOH>W(OH)2
查看答案和解析>>
科目:高中化学 来源:2016届浙江省宁波市等十校高三3月联考理综化学试卷(解析版) 题型:填空题
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g) CH3OH(g) △H
CH3OH(g) △H
(1)已知CO(g)、H2(g)的标准燃烧热分别为-285.8kJ•mol-1,-283.0kJ•mol-1,
且CH3OH(g)+3/2O2(g)  CO2(g)+2H2O(l) △H=-761kJ/mol;
CO2(g)+2H2O(l) △H=-761kJ/mol;
则CO(g)+ 2H2(g) CH3OH(g)的△H= 。
CH3OH(g)的△H= 。
(2)若将等物质的量的CO和H2混合气体充入恒温恒容密闭容器中进行上述反应,下列事实能说明此反应已达到平衡状态的是 。
A.容器内气体密度保持不变 B.混合气体的平均相对分子质量不变
C.生成CH3OH的速率与生成H2的速率相等 D.CO的体积分数保持不变
(3)下列措施中既有利于增大该反应的反应速率又能增大CO转化率的是 。
A.将CH3OH及时从混合物中分离
B.降低反应温度
C.恒容装置中充入H2
D.使用高效催化剂
(4)在容积为2L的恒容容器中,分别研究反应在300℃、350℃和400℃三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答:
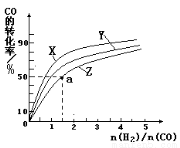
①在上述三种温度中,曲线X对应的温度是
②利用图中a点对应的数据,计算出曲线Z在对应温度下
CO(g)+ 2H2(g)  CH3OH(g) 的平衡常数K = 。
CH3OH(g) 的平衡常数K = 。
(5)其他条件相同时,某同学研究该甲醇合成反应在不同催化剂Ⅰ或Ⅱ作用下反应相同时间时,CO的转化率随反应温度的变化情况。请在右图中补充t℃后的变化情况。

查看答案和解析>>
科目:高中化学 来源:2016届浙江省宁波市等十校高三3月联考理综化学试卷(解析版) 题型:选择题
X、Y、Z、W、M为原子序数依次增大的短周期主族元素。已知:①元素对应的原子半径大小为:X<Z<Y<M<W;②Y是组成有机物的必要元素 ③Z与X可形成两种常见的共价化合物,与W可形成两种常见的离子化台物;④M的电子层数与最外层电子数相等。下列说法不正确的是( )
A.W、M的离子半径及最高价氧化物对应水化物的碱性皆为M<W
B.YZ 2为直线型的共价化合物,W2Z2既含有离子键又含有共价键
C.Y与X形成的化合物的熔沸点一定低于Z与X形成的化合物的熔沸点
D.Z与M形成的化合物可作为耐高温材料,W、M、X以1:1:4组成的化合物是应用前景很广泛的储氢材料,具有很强的还原性
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三第八次模拟理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】钴(Co)是人体必需的微量元素。含钴化合物作为颜料,具有悠久的历史,在机械制造、磁性材料等领域也具有广泛的应用。
请回答下列问题:
(1)Co基态原子的电子排布式为 ;
(2)酞菁钴近年来在光电材料、非线性光学材料、光动力学疗法中的光敏剂、催化剂等方面得到了广泛的应用。其结构如图所示,中心离子为钴离子。
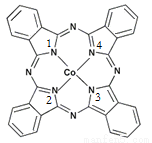
①酞菁钴中三种非金属原子的电负性由大到小的顺序为 ;(用相应的元素符号作答);碳原子的杂化轨道类型为 ;
②与钴离子通过配位键结合的氮原子的编号是 ;
(3)CoCl2中结晶水数目不同呈现不同的颜色。
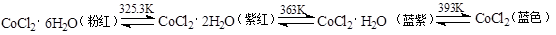
CoCl2可添加到硅胶(一种干燥剂,烘干后可再生反复使用)中制成变色硅胶。简述硅胶中添加CoCl2的作用: ;
(4)用KCN处理含Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN)6]4-,该配离子具有强还原性,在加热时能与水反应生成淡黄色[Co(CN)6]3-,写出该反应的离子方程式: ;
(5)Co的一种氧化物的晶胞如右图所示,在该晶体中与一个钴原子等距离且最近的钴原子有_________个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如下图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成是 。

查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏六盘山高中高一下期中化学试卷(解析版) 题型:填空题
下表为元素周期表的一部分,参照元素①-⑧在表中的位置回答下列问题(每空2分,共16分)
族 周期 | IA | O | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④、⑤、⑥的原子半径由大到小的顺序为__________。(用元素符号表示)
(2)②、③、⑧的最高价氧化物对应水化物的酸性由强到弱的顺序是_____________。(用化学式表示)
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的化学式:____________________。
(4)可以说明⑤、⑥元素原子失去电子能力相对强弱的一个事实是 。
(5)⑥和⑧的最高价氧化物对应水化物反应的离子方程式为 。
(6)②和①能形成一种6原子、16电子的分子,该分子的结构简式为 。
(7)②和①能形成一种相对分子质量为58的分子,该分子各种同分异构体的结构简式为 、 。(可补充)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com