
【题目】实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:

请回答下列问题:
(1)实验室只有100mL、250mL、500mL三种规格的容量瓶,但要配制480 mL 0.50 mol/L的稀硫酸,需量取该浓硫酸______mL。
(2)接下来完成此实验你将用到的仪器有20mL量筒、烧杯、玻璃棒、胶头滴管、____________。
(3)使用容量瓶前必须进行的一步操作是____________。
(4)要从所配溶液中取出10 mL稀释至20 mL,则稀释后溶液的物质的量浓度为__________。
(5)下列操作会使所配溶液浓度偏低的是__________。
A. 用量筒量取浓硫酸,读数时仰视刻度线
B. 转移溶液时未洗涤烧杯
C. 定容时俯视容量瓶的刻度线
D. 定容摇匀后,发现液面低于刻度线,再加水至刻度线
【答案】13.6 500 mL容量瓶 检漏 0.25 mol/L BD
【解析】
(1)配制480mL 0.50mol/L的稀硫酸,实验室没有480mL的容量瓶,应该选用500mL的容量瓶,根据稀释前后溶质的物质的量不变,据此计算;
(2)配制该物质的量浓度需要的仪器有500mL的容量瓶、胶头滴管、20mL量筒、烧杯、玻璃棒;
(4)稀释前后溶质的物质的量不变,10×10-3L×0.5molL-1=20×10-3L×c,c=0.25molL-1;
(5)A.用量筒量取浓硫酸,读数时仰视,量取的液体体积增大,溶质的物质的量偏大,所配溶液浓度偏大,不符合题意;
B.转移时,未洗涤烧杯,溶质的物质的量偏小,所配溶液的浓度偏低,符合题意;
C.定容时俯视容量瓶,所配溶液的体积偏小,物质的量浓度偏大,不符合题意;
D.定容时摇匀后,发现液面低于刻度线,再加水至刻度线,对原溶液稀释,物质的量浓度偏低,符合题意。
(1)配制480mL 0.50mol/L的稀硫酸,实验室没有480mL的容量瓶,应该选用500mL的容量瓶,稀释前后溶质的物质的量不变,V×1.84g/cm3×98%=500×103L×0.5mol/L×98g/mol,V=13.6mL,需要该浓硫酸13.6mL,
故答案为:13.6;
(2)配制该物质的量浓度需要的仪器有500mL的容量瓶、胶头滴管、20mL量筒、烧杯、玻璃棒,
故答案为:500mL容量瓶;
(3)使用容量瓶前必须进行的一步操作是检漏,
故答案为:检漏
(4)稀释前后溶质的物质的量不变, 10×10-3L×0.5molL-1=20×10-3L×c,c=0.25molL-1;
故答案为: 0.25mol/L;
(5)A.用量筒量取浓硫酸,读数时仰视,量取的液体体积增大,溶质的物质的量偏大,所配溶液浓度偏大,不符合题意;
B. 转移时,未洗涤烧杯,溶质的物质的量偏小,所配溶液的浓度偏小,符合题意;
C. 定容时俯视容量瓶,所配溶液的体积偏小,物质的量浓度偏大,不符合题意;
D. 定容时摇匀后,发现液面低于刻度线,再加水至刻度线,对原溶液稀释,物质的量浓度偏低,符合题意;
故答案为:BD。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】某学习小组设计以下的实验方案,测定镁铝合金中铝的质量分数。
方案一:将m1g镁铝合金中溶解在足量的试剂X中,充分反应后,过滤、洗涤、干燥、称量,得到质量为m2 g的固体。
(1)试剂X是_____,反应的离子方程式是____;
(2)如果在实验的过程中,没有对固体进行洗涤,则测得铝的质量分数将_____(填“偏大”“偏小”或“无影响”)。
方案二:选择如图所示的装置和药品。

(3)组装完仪器以后,需要进行的实验操作是_____;
(4)导管a的作用是______;
(5)读数时需要注意的事项有_____;
(6)如果合金的质量是a g,测得气体的体积为b L(已换算为标准状况时的体积),则合金中铝的质量分数是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol·L﹣1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )

A.OA段所发生反应的离子方程式:H++OH﹣=H2O;CO32﹣+H+=HCO3-
B.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1
C.产生的CO2体积(标准状况下)为0.056 L
D.原NaOH溶液的物质的量浓度为0.5 mol·L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为VL的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)![]() 2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法不正确的是( )
2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法不正确的是( )

A.由图可知:T1>T2
B.a、b两点的反应速率:b>a
C.为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法
D.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2和Na2CO3组成的固体混合物与200mL稀盐酸刚好反应完全后,收集到标准状况下的气体3.36L,所得溶液中含NaCl 0.4mol,下列说法错误的是
A.稀盐酸的物质的量浓度是2 mol/L
B.原固体混合物中Na2O2的质量是7.8g
C.上述反应过程中,Na2O2和Na2CO3产生气体的体积比为1:1
D.该混合气体的平均摩尔质量为40 g/ mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应A(g)+2B(g)![]() 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
A.C的生成速率与C分解的速率相等
B.单位时间内生成nmol A,同时生成2nmol B
C.单位时间内消耗nmol A,同时生成2nmol C
D.B的生成速率与C分解的速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是硫酸试剂瓶标签上的内容:

(1)某化学兴趣小组进行硫酸性质的实验探究时,需要490mL 4.6mol·L-1的稀硫酸,现要配制该浓度的溶液所需的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要__________(填仪器名称);需要量取98%浓硫酸____________mL进行配制;
(2)配制溶液时有如下操作:a.稀释溶解b.摇匀c.洗涤d.冷却e.量取f.将溶液移至容量瓶g.定容,实验操作顺序正确的是(___________)。
A. e→a→f→d→c→f→g→b B. e→a→d→f→c→f→g→b
C. e→a→f→d→c→f→b→g D. e→a→d→f→c→f→b→g
(3)下列为配制过程中部分操作的示意图,其中有错误的是____(填序号);
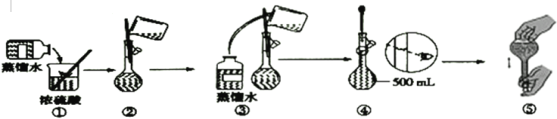
(4)在配制4.6mol·L-1稀硫酸的过程中,下列情况会引起配制所得的硫酸溶液物质的量浓度偏高的是___;
A.未经冷却趁热将溶液注入容量瓶中 B.容量瓶洗涤后,未干燥处理
C.定容时仰视观察液面 D.未洗涤烧杯和玻璃棒
(5)为中和100mL 2.3 mol·L-1KOH溶液后显中性,需要加入________mL 4.6mol·L-1稀硫酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A. B.
B.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图。又知AgCl的Ksp=1.8×10-10。下列说法不正确

A.t°C时,Ag2CrO4的Ksp为1×10-8
B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.t°C时,Y点和Z点的Ag2CrO4的Ksp相等
D.t°C时,将0.01 mol·L-1AgNO3溶液滴入20 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com