
现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示的转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )。
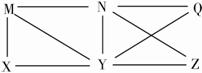
A.X可能为Al或Cl2
B.Y一定为NaOH(aq)
C.N一定是HCl(aq)
D.Q、Z中的一种必为Al2O3
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
0.04 mol·L-1 HCN溶液与0.02 mol·L-1 NaOH溶液等体积混合(忽略体积变化),已知混合溶液中[CN-]<[Na+],则下列关系中,正确的是( )
A.[Na+]>[CN-]>[H+]>[OH-]
B.[HCN]+[CN-]=0.04 mol·L -1
-1
C.[Na+]=[CN-]+[OH-]
D.[HCN]>[Na+]>[CN-]
查看答案和解析>>
科目:高中化学 来源: 题型:
对右图两种化合物的结构或性质描述正确的是( )。
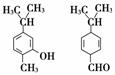
A.不是同分异构体
B.分子中共平面的碳原子数相同
C.均能与溴水反应
D.可用红外光谱区分,但不能用核磁共振氢谱区分
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是(双选)( )。
A.氯气的性质很活泼,与氢气混合后立即发生爆炸
B.实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
C.新制氯水的氧化性强于久置氯水
D.除去Cl2气体中的HCl,可将气体通入饱和食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
目前钢铁是日常生活中使用最广泛的金属,下列关于铁的一些说法正确的是( )。
A.常温下浓硫酸与铁不反应,故常温下可用铁制容器贮藏贮运浓硫酸
B.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3
C.Fe(OH)2易被氧化成Fe(OH)3,说明稳定性:Fe(OH)2<Fe(OH)3
D.Fe3O4溶解于盐酸既有FeCl2又有FeCl3生成,故Fe3O4属于混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组以苯和乙烯为主要原料,采用以下路线合成药物普鲁卡因:
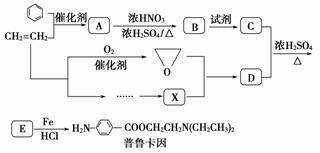
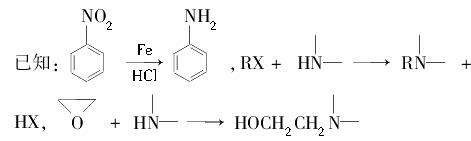
请回答下列问题:
(1)对于普鲁卡因,下列说法正确的是________。
A.可与浓盐酸形成盐
B.不与氢气发生加成反应
C.可发生水解反应
D.能形成内盐
(2)写出化合物B的结构简式________________。
(3)写出B→C反应所需的试剂________。
(4)写出C+D―→E的化学反应方程式__________________________________________
__________________________________________。
(5)写出同时符合下列条件的B的所有同分异构体的结构简式________。
①分子中含有羧基
②1HNMR谱显示分子中含有苯环,且苯环上有两种不同化学环境的氢原子
(6)通常采用乙烯为原料制得环氧乙烷后与X反应合成D,请用化学反应方程式表示以乙烯为原料制备X的合成路线(无机试剂任选)。
__________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
设C(s)+CO2(g)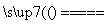 2CO(g)(ΔH=Q1 kJ·mol-1)反应速率为v1,N2(g)+3H2(g)
2CO(g)(ΔH=Q1 kJ·mol-1)反应速率为v1,N2(g)+3H2(g)
 2NH3(g)(ΔH=-Q2 kJ·mol-1)反应速率为v2,对于上述两个反应,当温度升高时,v1和v2的变化情况为( )
2NH3(g)(ΔH=-Q2 kJ·mol-1)反应速率为v2,对于上述两个反应,当温度升高时,v1和v2的变化情况为( )
A.同时增大 B.同时减小
C.v1增大,v2减小 D.v1减小,v2增大
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示容积固定的密闭容器中进行的某一可逆反应:A(g)+2B(g)
 2C(g),以B浓度表示反应速率与时间的关系,已知速率单位为mol·L-1·s-1,图中阴影面积的数值相当于( )
2C(g),以B浓度表示反应速率与时间的关系,已知速率单位为mol·L-1·s-1,图中阴影面积的数值相当于( )
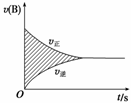
A.A浓度的减少量 B.B浓度的减少量
C.C物质的量的增加量 D.B物质的量的减少量
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚锡(SnSO4)可用于镀锡工业。某小组设计SnSO4制备路线为
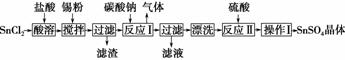
查阅资料:
Ⅰ.锡在酸性溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。
(1)锡原子的核电荷数为50,与碳元素同处 ⅣA族,锡位于周期表的第________周期。
(2)操作Ⅰ是 ________、过滤和洗涤等。
(3)溶解SnCl2粉末时需加浓盐酸,原因为__________________________________________________________。
(4)加入Sn粉的作用为①调节溶液pH,②__________________________________________________________。
(5)反应Ⅰ所得沉淀是SnO,其化学反应方程式:__________________________________________________________。
(6)酸性条件下,SnSO4与双氧水反应的离子方程式:__________________________________________________________。
(7)该小组通过下列方法可测定该锡粉的纯度:
①将试样溶于盐酸,反应为Sn+2HCl===SnCl2+H2↑
②加入过量的FeCl3
③用已知浓度的K2Cr2O7滴定②中生成的Fe2+,再计算锡粉的纯度,请配平反应:
FeCl2+____K2Cr2O7+____HCl===____FeCl3+____KCl+____CrCl3+____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com