
【题目】下列事实与对应的方程式不符合的是
A. 自然界中正常的雨水呈酸性:H2O+CO2![]() H2CO3 ,H2CO3
H2CO3 ,H2CO3![]() H++HCO3—
H++HCO3—
B. “NO2球”浸泡在冷水中,颜色变浅:2NO2(g) (红棕色)![]() N2O4 (g) (无色) ΔH<0
N2O4 (g) (无色) ΔH<0
C. 甲烷的燃烧热为-890.3 kJ·mol—1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
D. 硫代硫酸钠溶液与稀硫酸混合出现浑浊:S2O32-+2H+=S +SO2 +H2O
【答案】C
【解析】A. 空气中的二氧化碳溶于水生成碳酸,碳酸部分发生电离。B. 2NO2(g)(红棕色)![]() N2O4 (g)(无色) ΔH<0,降低温度,平衡右移;C. 1mol可燃物完全燃烧生成稳定的氧化物所放出的热量为燃烧热,水的状态应该为液态;D. 硫代硫酸钠溶液与稀硫酸混合生成单质硫,出现浑浊。
N2O4 (g)(无色) ΔH<0,降低温度,平衡右移;C. 1mol可燃物完全燃烧生成稳定的氧化物所放出的热量为燃烧热,水的状态应该为液态;D. 硫代硫酸钠溶液与稀硫酸混合生成单质硫,出现浑浊。
空气中的二氧化碳溶于水生成碳酸,碳酸部分发生电离,A正确;2NO2(g)(红棕色)![]() N2O4 (g)降低温度,平衡正向移动, NO2浓度降低,颜色变浅,该反应为放热反应,B正确;1mol可燃物完全燃烧生成稳定的氧化物所放出的热量为燃烧热,水的状态应该为液态,正确的热化学方程式为: CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890.3 kJ·mol-1,C错误;硫代硫酸钠溶于水,完全电离,与稀硫酸混合出现浑浊:S2O32-+2H+=S +SO2 +H2O,D正确;正确选项:C。
N2O4 (g)降低温度,平衡正向移动, NO2浓度降低,颜色变浅,该反应为放热反应,B正确;1mol可燃物完全燃烧生成稳定的氧化物所放出的热量为燃烧热,水的状态应该为液态,正确的热化学方程式为: CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890.3 kJ·mol-1,C错误;硫代硫酸钠溶于水,完全电离,与稀硫酸混合出现浑浊:S2O32-+2H+=S +SO2 +H2O,D正确;正确选项:C。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】恒温、恒压下,在一个可变容积的容器中发生反应:A(g)+B(g) ![]() C(g)
C(g)
(1)若开始时放入1molA和1molB,达到平衡后,生成amolC,这时n(A)为________mol。
(2)若开始时放入3molA和3molB,达到平衡后,生成n(C)为________mol。
(3)若开始时放入x mol A、2mol B和1mol C,达到平衡后,A和C的物质的量分别是ymol和3amol,则x=________,y=________。平衡时,n(B)________(填序号)。
A.大于2mol B.等于2mol C.小于2mol D.可能大于、等于或小于2mol
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是________。
(5)若保持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。开始时放入1molA和1molB,达到平衡后,生成b molC,将b与a进行比较,则________(填序号)。
A.a<b B.a>b C.a=b D.不能比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是

A. T1>T2 △H > 0
B. 该反应进行到M点放出的热量等于进行到W点放出的热量
C. M点的正反应速率v(正)大于N点的逆反应速率v(逆)
D. M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代火法炼锌过程中发生了以下三个主要反应。下列说法正确的是
① 2ZnS(s) + 3O2(g)=2ZnO(s)+2SO2(g) △H1=a kJ mol-1
② 2C(s) +O2(g)=2CO(g) △H2=b kJ mol-1
③ ZnO(s) +CO(g)=Zn(g) +CO2(g) △H3=c kJ mol-1
A. 以上三个反应中,只有①是放热反应
B. 反应②的作用是仅为反应③提供还原剂
C. 用这种方法得到的是纯净的锌单质
D. 反应ZnS(s)+C(s)+2O2(g)=Zn(g)+SO2(g)+CO2(g)的△H=![]() kJ mol-1
kJ mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁钉在氯气中被锈蚀为棕褐色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。在Cl2、Cl-、H+中,具有氧化性的是____________,其中氧化性最强的是____________。
(2)盐酸在不同的反应中可以分别表现出酸性、氧化性和还原性。现在有如下三个反应,请写出盐酸在三个反应中分别起何种作用:
①Zn+2HCl===ZnCl2+H2↑____________________;
②NaOH+HCl===NaCl+H2O__________________;
③2HCl![]() H2↑+Cl2↑________________________。
H2↑+Cl2↑________________________。
(3)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成浅绿色溶液(FeCl2);向浓盐酸中滴加KMnO4溶液产生淡黄绿色气体(Cl2)。在Cl2、H+、![]() 中,__________________氧化性最强。
中,__________________氧化性最强。
(4)高锰酸钾与氢溴酸溶液可以发生下列反应:2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O。其中还原剂是________________。若消耗15.8 g氧化剂,则被氧化的还原剂的质量是______________g。HBr的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟合成医药中间体X。

请回答:
(1)下列说法正确的是_________。
A.化合物B不能使溴水褪色
B.化合物C能与CuO发生氧化反应
C.化合物D的分子式是C9H10O2Br
D.化合物E到F发生的是加成反应
(2)化合物H的结构简式是________。
(3)已知I→X是取代反应,写出该反应的化学方程式________。
(4)化合物G的同分异构体有以下特征:①含有苯环;②1H﹣NMR谱显示分子中有3种氢原子;③分子结构中不存在氧氧键。请写出所有符合要求的结构简式(或键线式)___。
(5)已知:①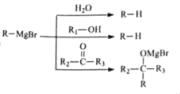 ;②
;② ,请结合题目中已知信息设计由
,请结合题目中已知信息设计由![]() 合成
合成![]() 的路线________________________(用流程图表示)。
的路线________________________(用流程图表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某体积可变的密闭容器中盛有适量的N2和H2的混合气体,在一定条件下发生反应:N2(g)+3 H2 (g)![]() 2NH3(g),若维持温度和压强不变,当达到平衡时,容器的体积为V L,其中NH3的体积是0.1 V L。下列说法正确的是
2NH3(g),若维持温度和压强不变,当达到平衡时,容器的体积为V L,其中NH3的体积是0.1 V L。下列说法正确的是
A. 原混合气体的体积为1.2V L B. 反应达平衡时N2消耗掉0.2 V L
C. 原混合气体的体积为1.1VL D. 反应达平衡时H2消耗掉0.5 V L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁,可按如下步骤进行:
①把贝壳制成石灰乳;
②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;
④将得到的产物熔融电解得到镁。
下列说法不正确的是( )
A. 此法的优点之一是原料来源丰富B. ①②③步骤的目的是从海水中提取镁盐
C. ①②③步骤涉及化合、分解和复分解反应D. 第①到第④步的反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的()
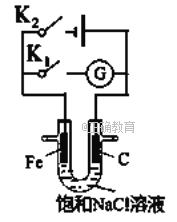
A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液碱性增强
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com