
分析 (1)根据CO、CH4的体积之和、消耗的氧气列方程计算二者体积,再计算出混合气体中CH4的体积分数;
(2)燃烧发生反应:2CO+O2=2CO2、CH4+2O2=CO2+2H2O(g),燃烧后体积变化由CO燃烧导致,根据差量法计算CO的体积,进而计算甲烷的体积,由于完全燃烧,故0.5V(CO)+2V(CH4)≤b,据此解答.
解答 解:(1)燃烧的方程式分别为:2CO+O2=2CO2、CH4+2O2=CO2+2H2O(g),根据碳原子守恒可知,V(CO)+V(CH4)=V(CO2),故a=b,
则:V(CO)+V(CH4)=a,0.5V(CO)+2V(CH4)=a,解得:V(CO)=$\frac{2}{3}$amL,则:V(CH4)=$\frac{a}{3}$mL,
所以混合气体中甲烷的体积分数为:$\frac{\frac{a}{3}mL}{amL}$×100%=33%,
故答案为:33%;
(2)燃烧发生反应:2CO+O2=2CO2、CH4+2O2=CO2+2H2O(g),燃烧后体积变化由CO燃烧导致,则:
2CO+O2=2CO2 体积减少△V
2 1
V(CO) $\frac{a}{4}$mL
故V(CO)=0.5amL,V(CH4)=0.5amL,
由于完全燃烧,故0.5V(CO)+2V(CH4)≤b,即0.5a×0.5+2×0.5a≤b,故b≥$\frac{5}{4}$a,
故答案为:b≥$\frac{5}{4}$a.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握讨论法在化学计算中的应用,试题侧重考查学生的分析能力及化学计算能力.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | X的非金属性强于W,所以X的氢化物沸点高于W的氢化物沸点 | |
| B. | Y、Z均为金属元素,故X、Y、Z三种元素不能形成化合物 | |
| C. | 工业上常利用电解ZW3溶液冶炼金属Z | |
| D. | Y、W的最高价氧化物水化物均能溶解Z单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 工业上常用电解法制备元素C、D、E的单质 | |
| C. | 化合物AE、CE都是电解质,融化状态下能被电解 | |
| D. | 一定条件下,元素D、E的最高价氧化物对应的水化物之间不能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
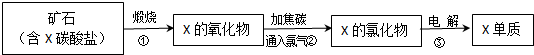
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 存在顺反异构 | B. | 经加聚反应得树脂 | ||
| C. | 属于盐类 | D. | 使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a mol FeI2溶液中通入2a mol Cl2:2Fe2++4I-+3Cl2═2I2+2Fe3++6C1- | |
| B. | 碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3-+2OH-═CO32-+NH3•H2O+H2O | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| D. | 硅酸钠溶液中通入过量的CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1×10-1mol/L | B. | 1×10-7mol/L | C. | 1×10-11mol/L | D. | 1×10-13 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com