
下列有关电解质溶液的说法正确的是 ( )
A、向0.1mol/L的CH3COOH溶液中加少量水,溶液中 减小
减小
B、将CH3COONa溶液从20℃升温至30℃,溶液中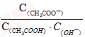 增大
增大
C、向盐酸中加入氨水至中性,溶液中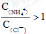
D、向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液 中
中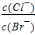 不变
不变
科目:高中化学 来源:2016-2017学年浙江省杭州市五校高一上学期联考化学试卷(解析版) 题型:实验题
某实验需要80 mL0.500 mol/LNa2CO3溶液。某同学用碳酸钠晶体(Na2CO3·10H2O)来配制所需溶液,现提供以下仪器:
①带有刻度的250 mL烧杯 ②100 mL量筒 ③细口试剂瓶 ④胶头滴管 ⑤玻璃棒 ⑥托盘天平(带砝码及两张质量大小相等的纸)⑦标签纸 ⑧药匙
请回答下列问题:
(1)还缺少的仪器是______________。
(2)需要称取碳酸钠晶体的质量为________g。
(3)实验中两次用到玻璃棒,其作用分别是________________。
(4)配制过程中有一个步骤是洗涤,其操作是用少量蒸馏水洗涤____________。
(5)配制0.500 mol/L的Na2CO3溶液时,下列因素会导致所配溶液浓度偏低的是_________(填字母)。
A.称量时,左盘砝码,右盘药品 |
B.定容时,俯视读取刻度 |
C.定容时加水超过刻度线,立即用干净的胶头滴管将多余的溶液吸出 |
D.使用部分风化的碳酸钠晶体来配制溶液 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市宝坻区高二11月联考化学试卷(解析版) 题型:选择题
用物质的量都是0.1mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中c(CH3COO-)大于c(Na+)。对该混合溶液的下列判断正确的是( )
A、c(OH-)> c(H+) B、c(CH3COOH)+c(CH3COO-)=0.2mol/L
C、c(CH3COOH)>c(CH3COO-) D、c(CH3COO-)+c(OH-)=0.2mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市宝坻区高二11月联考化学试卷(解析版) 题型:选择题
对可逆反应4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(g),下列叙述正确的是( )
4NO(g)+ 6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,4υ 正(O2)= 5υ逆(NO )
正(O2)= 5υ逆(NO )
B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
NH3 ,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则 正反应速率减少,逆反应速率增大
正反应速率减少,逆反应速率增大
D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二12月月考化学试卷(解析版) 题型:实验题
国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用题图1装置(夹持装置略)收集某葡萄酒中SO2,并对含量 进行测定。
进行测定。
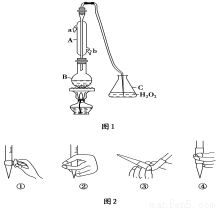
(1)图2中①的仪器名称 。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为 。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1 的NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________;滴定的终点现象 ;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积 (填序号)___________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为:___________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施______________________。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三新考试大纲适应性考试化学卷(解析版) 题型:实验题
[化学—选修5:有机化学基础]A的产量可以用来衡量—个国家的石油化工发展水平。用A为原料可以合成一种醚类香料和一种缩醛类香料。具体合成路线如下图所示(部分反应条件略去):
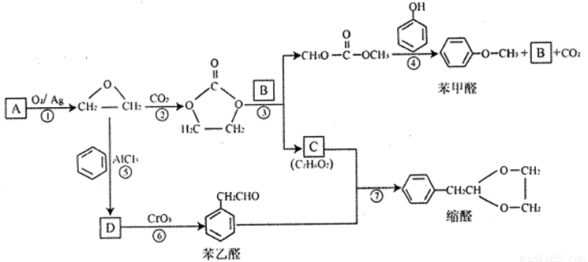
回答下列问题:
(1)A的名称是_______,图中缩醛的分子式是_______________。
(2)B的结构简式为__________,C中含有的官能团名称是________________。
(3)D为单取代芳香族化合物且能与金属钠反应。反应⑤的化学方程式为_______________。
(4)反应⑥的反应类型是__________________。
(5)写出满足下列条件的苯乙醛的所有同分异构体的结构简式:______________。
A.含有苯环和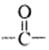 结构;B.核磁共振氢谱有4组峰,且峰面积之比为3:2:2:1
结构;B.核磁共振氢谱有4组峰,且峰面积之比为3:2:2:1
(6)参照 的合成路线,设计一条由2-氯丙烷制备
的合成路线,设计一条由2-氯丙烷制备 的合成路线(注明必要的反应条件)________________。
的合成路线(注明必要的反应条件)________________。
查看答案和解析>>
科目:高中化学 来源:2017届广西省钦州市钦州港区高三12月月考化学试卷(解析版) 题型:填空题
目前工业合成氨的原理是:N2(g)+3H2(g)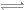 2NH3(g) △H=-93.0kJ/mol
2NH3(g) △H=-93.0kJ/mol
(1)己知一定条件下:2N2(g)+6H2O(l)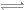 4NH3(g)+3O2(g) △H=+1530.0kJ/mol。则表示氢气燃烧热的热化学方程式为____________________。
4NH3(g)+3O2(g) △H=+1530.0kJ/mol。则表示氢气燃烧热的热化学方程式为____________________。
(2)在恒温恒容装置中进行合成氨反应,各组分浓度-时间图像如下。
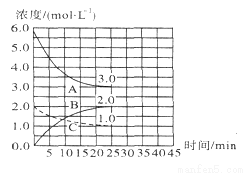
① 表示N2浓度变化的曲线是 (填序号)。
② 前25min 内,用H2浓度变化表示的化学 反应速率是 。
反应速率是 。
③ 在25min时,采取下列措施,能使N2的转化率提高的是__________(填序号)。
a. 通入1molN2
b. 通入1molH2
c. 通入1molHe气
d. 通入1molHCl
e. 通入1molN2和3molH2
(3)在恒温恒压装置中进行工业合成氨反应,下列说法错误的是__________(填序号)。
a.气体体积不再变化,则已平衡
b.气体密度不再变化,则已平衡
c.平衡后,压缩容器,会生成更多NH3
d.平衡后,往装置中通入一定量Ar,平衡不移动
(4)电厂烟气脱氮:主反应为:①4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H<0
5N2(g)+6H2O(g) △H<0
副反应为:②2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) △H>0
5N2O(g)+3H2O(g) △H>0
平衡混合气中N2与N2O含 量与温度的关系如图所示。
量与温度的关系如图所示。

请回答:在400~600K时,随温度的升高,平衡混合气中N2含量_____________(填“升高”、“降低”或“不变”),导致这种规律的原因是_______________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017黑龙江牡丹江第一高级中学高二上期末化学卷(解析版) 题型:简答题
如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:
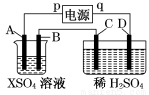
(1)p为________极,A极发生了_____ ___反应。
(2)C为________极,可收集到_____ ___;
D为________极,可收集到___ _ ____。
(3)C极的电极反应式为________________________。
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如下表:
时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
阴极产生气体的体积(cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 59 | 69 | 79 | 89 |
阳极产生气体的体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
仔细分析以上实验数据,请说出变化的可能原因是___________________。
(5) 当电路中通过0.004 mol电子时,B极上沉积的金属X为0.128 g,则此金属的摩尔质量为_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com