
【题目】室温下,下列指定溶液中微粒的浓度关系正确的是
A. 0.1mol ·L-1Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+ c(H2CO3)
B. 0.1mol ·L-1NH4Cl溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C. 0.2mol ·L-1H2C2O4(弱酸)与0.1mol ·L-1 NaOH溶液等体积混合的溶液中:2[c(H+)-c(OH-)]=3c(C2O42-)-c(H2C2O4)+ c(HC2O4-)
D. 0.1mol ·L-1Na2CO3溶液与同浓度等体积盐酸混合的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)
【答案】BC
【解析】A. 根据碳酸钠溶液中的质子守恒判断;B. 铵根离子部分水解,溶液呈酸性,则c(Cl-)>c(NH4+)、c(H+)>c(OH-);C. 反应后溶质为等浓度的H2C2O4和NaHC2O4,根据混合液中的核电荷数和物料守恒判断;D. 反应后溶质为等浓度的碳酸氢钠和氯化钠,碳酸氢根离子的水解程度大于其电离程度,则c(HCO3-) >c(CO32-)。
A. 根据0.1mol·L-1Na2CO3溶液中的质子守恒可得: c(OH-)=c(H+)+c(HCO3-)+ 2c(H2CO3),故A选项是错误的;
B. 0.1mol ·L-1NH4Cl溶液中,铵根离子发生水解,溶液显示酸性,则c(H+)>c(OH-),溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),所以B选项是正确的;
C. 反应后溶质为等浓度的H2C2O4和NaHC2O4,根据电荷守恒可得:①c(Na+)+ c(H+)= c(OH-)+ c(HC2O4-)+ 2c(C2O42-),根据物料守恒可得:②2c(Na+)= c(H2C2O4)+ c(HC2O4-)+c(C2O42-),将①![]() 2-②可得: 2c(H+)+c(H2C2O4)=3c(C2O42-)+c(HC2O4-)+2c(OH-),整理可得: 2[c(H+)-c(OH-)]=3c(C2O42-)-c(H2C2O4)+ c(HC2O4-),所以C选项是正确的;
2-②可得: 2c(H+)+c(H2C2O4)=3c(C2O42-)+c(HC2O4-)+2c(OH-),整理可得: 2[c(H+)-c(OH-)]=3c(C2O42-)-c(H2C2O4)+ c(HC2O4-),所以C选项是正确的;
D. 0.1mol ·L-1Na2CO3溶液与同浓度等体积盐酸混合,反应后溶质为等浓度的碳酸氢钠和NaCl,因为碳酸氢根离子的水解和电离程度都较小,则c(HCO3-)>c(CO32-),正确的离子浓度大小为: c(Na+)>c(Cl-)> c(HCO3-) >c(CO32-),故D选项是错误的。
所以BC选项是正确的。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关仪器的使用正确的是
A.手持试管给试管内的物质加热
B.用滴管滴加液体时滴管应垂直悬垂在容器上方且不能触及容器内壁
C.用天平称量药品时用手直接拿砝码
D.用燃着的酒精灯去点燃另一盏酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C均为食品中常见的有机化合物,F是生活中常见的气体燃料,也是含氢百分含量最高的有机物,D和E有相同的元素组成。它们之间的转化关系如图:

请回答:
(1)有机物A中官能团的名称是________
(2)反应①的化学方程式___________
(3)F与氯气反应生成亿元取代物待测化学方程式___________
(4)下列说法正确的是____________
A.3个反应中的NaOH都起催化作用
B.反应⑤属于加成反应
C.A的同分异构体不能与金属钠反应生成氢气
D.1molB、1molC完全反应消耗NaOH的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符合的是
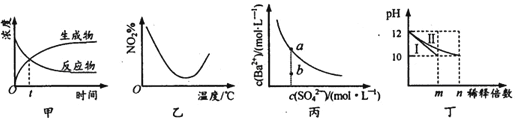
A. 图甲表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态
B. 图乙表示NO2在恒容密闭容器中发生反应:2NO2(g)![]() N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<O
N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<O
C. 图丙表示某温度时,BaSO4在水中的溶解平衡曲线,蒸发水可使溶液由b点变到a点
D. 图丁表示分别稀释l0mLpH均为12的NaOH和NH3·H2O溶液时pH的变化,曲线I表示NH3 H2O溶液,n>100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化器中发生的反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
容器 | 温度/(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||||
NO | CO | N2 | CO2 | N2 | CO2 | ||
I | 400 | 0.2 | 0.2 | 0 | 0 | 0.12 | |
II | 400 | 0.4 | 0.4 | 0 | 0 | ||
III | 300 | 0 | 0 | 0.1 | 0.2 | 0.075 | |
下列说法正确是
A. 容器I中达到平衡所需时间2s,则v(N2)=0.06 molL-1·s-1
B. 该反应的ΔS<0、ΔH<0
C. 达到平衡时,体系中c(CO)关系:c(CO,容器II)>2c(CO,容器I)
D. 若起始时向I中充入NO、CO、N2、CO2各0.1mol,开始时V正>V逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 有能量变化的过程均为化学变化
B. 原电池是将电能转变为化学能的装置
C. 反应物的总能量高于生成物的总能量时发生放热反应
D. 旧化学键断裂所放出的能量低于新化学键形成所吸收的能量时发生吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种新型锂电池装置,电池充、放电反应为![]()
![]()
![]() 。放电时,需先引发铁和氯酸钾反 应使共晶盐熔化。下列说法不正确的是
。放电时,需先引发铁和氯酸钾反 应使共晶盐熔化。下列说法不正确的是
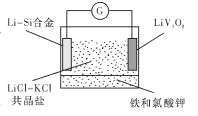
A. 共晶盐储热效果好,利于电解质熔化
B. 整个过程的能量转化只涉及化学能转化为电能
C. 放电时LiV3O8电极的反应为xLi++xe-+LiV3O8= Li1+XV3O8
D. 充电时 Cl-移向LiV3O8电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
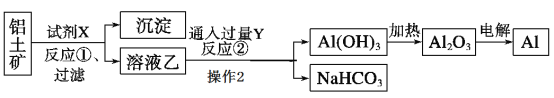
(1)试剂X应选择________(选填“氢氧化钠溶液”、“盐酸”),反应①过滤后所得沉淀为__ ;反应①的离子方程式_____;
(2)反应②中Y是_____(写化学式);
(3)写出由Al(OH)3加热为Al2O3的反应方程式_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com