
(14分)
一位同学在复习时遇到这样一道习题:某无色溶液中可能含有“H+、OH-、Na+、NO3-”,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子。
(1)加入铝粉产生H2,说明铝具有______(填“氧化性”或“还原性”)。
(2)该同学分析:若H+大量存在,则NO3-就不能大量存在。
设计实验证实如下:
| 装 置 | 现 象 |
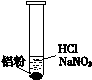 | ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,液面上方呈浅棕色 ⅲ. 试管变热,溶液沸腾 |
| 实 验 | 内 容 | 现 象 |
| 实验1 | 将湿润KI—淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI—淀粉试纸检验浅棕色气体 | 试纸变蓝 |
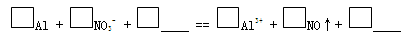
| 装 置 | 现 象 |
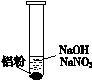 | ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,有刺激性气味 |
(14分)
(1)还原性
(2)① 6H+ + Al2O3 ="=" 2Al3+ + 3H2O
② a.NO2
b. 对比实验,排除氧气使湿润的淀粉KI试纸变蓝的可能
c. 1,1,4H+,1,1,2H2O
(3)① NH3
② 8Al +3NO3- + 5OH-+ 2H2O ="=" 3NH3↑+ 8AlO2-
(4)2Al +2NaOH + 2H2O ="=" 2NaAlO2 + 3H2↑
解析试题分析:(1)加入铝粉产生H2,说明铝具有还原性;
(2)① 盐酸溶解Al2O3薄膜,生成氯化铝和水,离子方程式为6H+ + Al2O3 ="=" 2Al3+ + 3H2O
②a.、浅棕色气体是NO2
b、实验1的目的是与实验2作对比,排除实验2中氧气使湿润的淀粉KI试纸变蓝的可能;
c、根据所学知识,Al与硝酸反应生成NO,所以反应物的空白应填写“H+”,所以产物中应有水存在,再根据得失电子守恒法、观察法配平方程式即可。配平后的离子方程式为:Al+NO3-+4H+=Al3++NO↑+2H2O
(3)①用湿润红色石蕊试纸检验,试纸变蓝。则使湿润红色石蕊试纸变蓝的气体是NH3;
② 该反应有氨气产生,说明Al与氢氧化钠溶液、硝酸钠溶液发生了氧化还原反应,离子方程式为:8Al +3NO3- + 5OH-+ 2H2O ="=" 3NH3↑+ 8AlO2-;
(4)Al与单一氢氧化钠溶液反应的化学方程式是2Al +2NaOH + 2H2O ="=" 2NaAlO2 + 3H2↑。
考点:考查铝与酸、碱溶液反应的产物的判断,NO3-的氧化性的判断,氨气的检验,化学方程式、离子方程式的书写


科目:高中化学 来源: 题型:填空题
A—J是中学化学中常见的物质,它们之间的转化关系如下框图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀。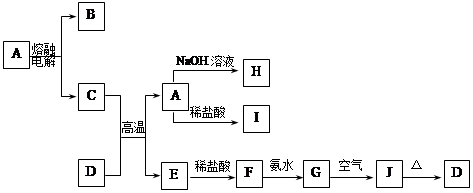
请回答下列问题:
(1)A的化学式为 ,在水中的溶解性 (选填“易溶”、“可溶”、“难溶”)。
(2)H溶液中通入过量的CO2,其反应的离子方程式是 。
G→J的化学方程式为 。
反应的现象是 。
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某化学探究小组设计如下方案制备上述两种产品: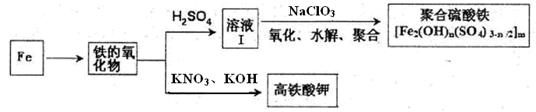
请回答下列问题:
(1)检验固体铁的氧化物中铁的化合价,应使用的试剂是 (填标号)
| A.稀硫酸 | B.稀硝酸 | C.KSCN溶液 | D.酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某氧化铁样品中含有少量的FeSO4杂质。某同学要测定其中铁元素的质量分数,他设计了如下方案进行测定,操作流程为: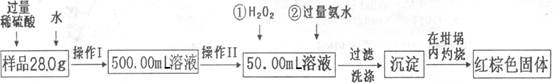
请根据流程回答:
(1)操作I中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有 (填仪器名称)。
(2)操作II中必须用到的仪器是 。
| A.50mL量筒 | B.100mL量筒 |
| C.50mL酸式滴定管 | D.50mL碱式滴定管 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知某物质A有如下转化关系: 
根据上图关系及实验现象,回答下列问题:
(1)A是 ,B是 ,G是 ,X是 (均填化学式)。
(2)写出反应Ⅱ的化学方程式 。
(3)写出反应Ⅲ的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)铁、铝、铜、硅及其合金材料在生产生活中有着广泛的应用。请回答下列有关问题。
(1)目前已冶炼出纯度达99.9999%的铁。下列关于纯铁的叙述错误的是
(填字母)。
| A.硬度比钢小,熔点比钢高 | B.不能与盐酸反应 |
| C.与不锈钢成分相同 | D.在冷的浓硫酸中钝化 |
 6Cu+SO2↑,该反应的氧化剂是
6Cu+SO2↑,该反应的氧化剂是 
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应。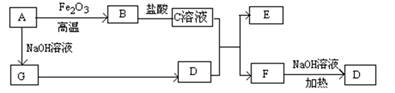
请回答下列问题:
(1)写出F的电子式 ;
(2)①C溶液与D反应的离子方程式为 ;
②F溶液与NaOH溶???共热反应的化学方程式为 ;
(3)①请用离子方程式解释C溶液为何显酸性 ;
②F溶液中离子浓度由大到小的顺序为 ;
(4)将5.4gA投入200mL 2.0mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是 (填代号)
A.HNO3溶液 B.H2SO4溶液 C.NaOH溶液 D.HCl溶液
(5)将1molN2和3molG及催化剂充入容积为2L的某密闭容器中进行反应,已知该反应为放热反应。平衡时,测得D的物质的量浓度为a mol/L。
①如果反应速率v(G)=1.2mol/(L·min),则v(D)= mol/(L·min)
②在其他条件不变的情况下,若起始时充入0.5molN2和1.5molG达到平衡后,D的物质的量浓度 (填“大于”、“小于”或“等于”)a/2 mol/L。
③该条件下的平衡常数为 (用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
总的物质的量为0.50 mol的Fe粉与Al粉混合物分为等质量的两份;在一份中加入足量
的稀盐酸,在标准状况下产生气体a L;在另一份中加入足量的氢氧化钠溶液,在标准状况下产生气体b L。则a+b的数值不可能是
| A.5.6 | B.7.3 | C.8.2 | D.11.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
我国化工专家侯德榜,勇于创新,改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献。请完成下列问题:
(1)“联合制碱法”制得的“碱”是 (填化学式)。
(2)氨碱法和联合制碱法是两大重要的工业制碱法,下列表达中,不正确的是 。
| | | 氨碱法 | 联合制碱法 |
| A | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
| B | 可能的副产物 | 氯化钙 | 氯化铵 |
| C | 循环物质 | 氨气、二氧化碳 | 氯化钠 |
| D | 评价 | 原料易得;设备复杂;能耗高 | 原料利用率高;废弃物少 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com