
元素的电离能对元素的性质影响很大。
(1)观察下表总结三条有关第一电离能变化的规律
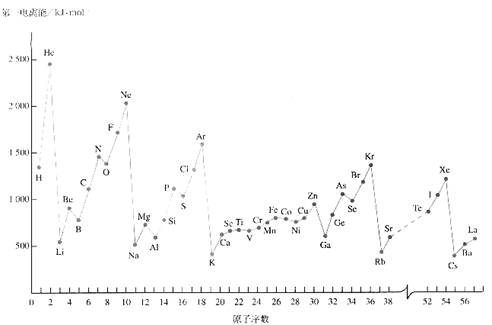
例如:同周期主族元素的第一电离能的变化趋势是由小变大;
;
;
。
(2)
| Li | Na | K | |
| 熔点 | 180 | 98 | 63 |
| 沸点 | 1347 | 881 | 756 |
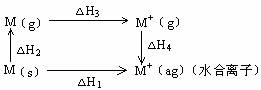
根据以上三个图表回答:(M表示碱金属)
△H2(Li) △H2(Na), △H3(Li) △H3(Na),
已知金属锂比钠活泼,则△H4(Li) △H4(Na)。
(3)钒(V)原子的基态电子排布式为: ,钒元素的最高化合价为 。
(4)CuO受热易分解为Cu2O和O2,请从铜的原子结构来说明CuO受热易分解的原因:
。
 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
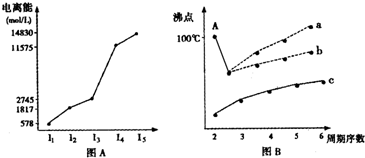
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 |  |
 |
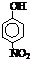 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 2 | 3 |
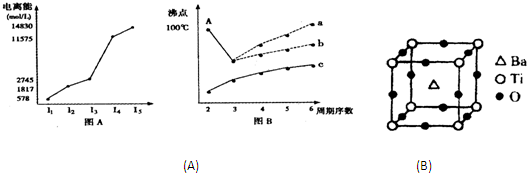
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省高三第一次月考化学试卷(解析版) 题型:填空题
(10分)决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
578 |
1817 |
2745 |
11578 |
|
B |
738 |
1451 |
7733 |
10540 |
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。
(2)已知:波长为300 nm的紫外光的光子,光子的能量与光的频率的关系为E=hv,式中h=6.63×10-34J·s,光的波长 与光的频率v的关系为
与光的频率v的关系为 ,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因: 。(未说明原因不给分)
,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因: 。(未说明原因不给分)
|
共价键 |
C—C |
C—N |
C—S |
|
键能/kJ·mol-1 |
347 |
305 |
259 |
(3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似。下表是3种离子晶体的晶格能数据:
|
离子晶体 |
NaCl |
KCl |
CaO |
|
晶格能/kJ·mol-1 |
786 |
715 |
3401 |
离子键的强弱可以用离子晶体的晶格能来衡量,KCl、CaO、TiN 3种离子晶体熔点从高到低的顺序是 。MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5)某配合物的分子结构如图所示,其分子内不含有 (填字母)。

A.离子键 B.共价键 C.配位键 D.氢键
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com