
【题目】在同温同压下,某有机物和过量Na反应得到V1 L氢气,取另一份等量的有机物和足量的NaHCO3反应得到V2 L二氧化碳,若2V1=V2≠0,则此有机物可能是 ( )
A. CH3CH(OH)COOHB. HOOCCH2COOH
C. HOCH2CH2OHD. HOCH2CH(OH)CH2COOH
科目:高中化学 来源: 题型:
【题目】H2S在金属离子的鉴定分析、煤化工等领域都有着重要应用。回答下列问题:
I.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时还生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为___。
II.H2S可用于检测和沉淀金属阳离子。
(2)由H2S制得的水溶液为氢硫酸,向氢硫酸中滴加少量的硫酸铜溶液,溶液中![]() ___(填“增大”或“减小”)。
___(填“增大”或“减小”)。
(3)已知:25℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27。该温度下,向浓度均为0.1mol·L-1的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=___(溶液体积变化忽略不计)。
III.H2S是煤化工原料气脱硫过程的重要中间体,反应原理如下:
i.COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7kJ·mol-1;
H2S(g)+CO(g) △H=+7kJ·mol-1;
ii.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-42kJ·mol-1。
CO2(g)+H2(g) △H=-42kJ·mol-1。
(4)已知:断裂1mol分子中的化学键所需吸收的能量如下表所示:

表中x=___。
(5)向10L溶积不变的密闭容器中充入1molCOS(g)、1molH2(g)和1molH2O(g),进行上述两个反应。
①随着温度升高,CO的平衡体积分数___(填“增大”或“减小”),其原因是___。
②T1℃时,测得平衡时体系中COS的物质的量为0.80mol,CO的体积分数为5%。则该温度下,达到平衡时H2的物质的量为___;反应i的平衡常数为___(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接碳固体氧化物燃料电池作为全固态的能量转换装置,采用固体碳作为燃料,以多孔Pt作电极、氧化锆为电解质,其工作原理如下图。下列说法不正确的是

已知:CO2(g)+C=2CO(g) △H=+172.5kJmol-1 CO(g)+![]() O2(g)=CO2(g)△H=-283kJmol-1
O2(g)=CO2(g)△H=-283kJmol-1
A.电极a为正极,电子由b经过导线到a
B.电极b发生的电极反应为:CO+O2--2e-=CO2
C.依据装置原理可推测,该条件下CO放电比固体C更容易
D.若1molC(s)充分燃烧,理论上放出的热量为110.5kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的说法正确的是( )
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(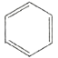 )看,78g苯中含有碳碳双键数为3NA
)看,78g苯中含有碳碳双键数为3NA
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的化学键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A为原料,经过以下途径可以合成一种重要的制药原料有机物F。
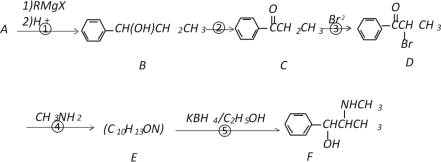
已知:
I.
II.A蒸气的密度是相同条件下氢气密度的53倍。
请回答下列问题:
(1)写出A的结构简式_____________;E中含氧官能团的名称为__________________。
(2)D→E的反应类型是_____________,E→F的反应类型是_________________。
(3)写出反应④的化学反应方程式___________________________________________。
(4)符合下列条件的C的同分异构体有________种(不考虑顺反异构)。
a.苯环上有两个取代基 b.能与NaOH溶液反应 c.分子中含有两种官能团
(5)C的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同的是(_______)(填字母序号)
A.核磁共振仪 B.元素分析仪 C.质谱仪 D.红外光谱仪
(6)以A为原料可以合成高分子化合物G(  ),请设计出合理的合成路线(无机试剂任选)。________________________________________________________________
),请设计出合理的合成路线(无机试剂任选)。________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2和O2的混合气体,在标准状态下,若将H2、O2的混合气体点燃引爆。活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为( )
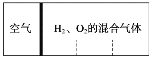
A. 2∶7B. 5∶4C. 4∶5D. 2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究酸化条件对0.1mol/LKI溶液氧化反应的影响。
序号 | 操作及现象 |
实验1 | 取放置一段时间后依然无色的0.1mol/LKI溶液,加入淀粉溶液,溶液不变蓝;向溶液中继续加入2滴6mol/L的稀硫酸,溶液立即变蓝 |
实验2 | 取新制的0.1mol/LKI溶液,加入淀粉溶液,溶液不变蓝;向溶液中继续加入2滴6mol/L的稀硫酸,溶液10s后微弱变蓝 |
(1)溶液变蓝,说明溶液中含有____________ 。结合实验1和实验2,该小组同学认为酸化能够加快I-氧化反应的速率。
(2)同学甲对滴加稀硫酸后溶液变蓝速率不同的原因提出猜想:放置一段时间后的0.1mol/LKI溶液成分与新制0.1mol/LKI溶液可能存在差异,并继续进行探究。
实验3:取新制0.1mol/LKI溶液在空气中放置,测得pH如下:
时间 | 5分钟 | 1天 | 3天 | 10天 |
pH | 7.2 | 7.4 | 7.8 | 8.7 |
资料:
ⅰ.pH<11.7时,I-能被O2氧化为I。
ⅱ.一定碱性条件下,I2容易发生歧化,产物中氧化产物与还原产物的物质的量之比为1∶5。
①用化学用语,解释0.1mol/LKI溶液放置初期pH升高的原因:_________________________________________________________。
②对比实验1和实验2,结合化学用语和必要的文字,分析实验1中加稀硫酸后“溶液立即变蓝”的主要原因可能是_____________________________________________________________________________________。
(3)同学甲进一步设计实验验证分析的合理性。
序号 | 操作 | 现象 |
实验4 | 重复实验2操作后,继续向溶液中加入 ________________。 | 溶液立即变蓝 |
(4)该组同学想进一步探究pH对I2发生歧化反应的影响,进行了如下实验。
实验5:用20mL 4种不同浓度的KOH溶液与2mL淀粉溶液进行混合,测量混合液的pH后,向其中加入2滴饱和碘水,观察现象。记录如下:
实验组 | A | B | C | D |
pH | 11.4 | 10.6 | 9.5 | 8.4 |
现象 | 无颜色变化 | 产生蓝色后瞬间消失 | 产生蓝色,30s后蓝色消失 | |
从实验5可以看出pH越大,歧化反应速率越_______________(填“快”或“慢”)。
解释pH=8.4时,“产生蓝色,30s后蓝色消失”的原因:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年4月26日,中田首艘国产航母在大连正式下水,标志着我国自主设计航空母舰取得重大阶段性成果。请回答下列问题:
(1)航母用钢可由低硅生铁冶炼而成。
①硅原子L能层的电子分布图为____________________;
②Fe3+比Fe2+稳定的原因是_____________________;
③铁氰化钾K3[Fe(CN)6]溶液可以检验Fe2+。1 mol CN-中含有π键的数为_________,与CN-互为等电子体的分子有__________(写出一种),铁氰化钾晶体中各种微粒间相互作用不包括_______________;
a. 离子键 b. 共价键 c.配位键 d. 金属键 e. 氢键 f. 范德华力
(2)航母螺旋桨主要用铜合金制造。含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。

①M所含元素的电负性由大到小的顺序为__________(用元素符号表示);
②X中采用sp3杂化的非金属原子有___________(填写元素名称),采用sp3杂化的原子有__________个;
(3)Fe3O4是Fe3+、Fe2+、O2-通过离子键而组成的复杂离子晶体。O2-的重复排列方式如图所示,已知该晶体的晶胞参数为a nm,密度为b g/cm3,则NA=__________mol-1。(列出含a、b的计算式)
 (白球表示O2-)
(白球表示O2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com