
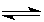
 2NO2(g),△H>0,达平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且V正<V逆的点是( )
2NO2(g),△H>0,达平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且V正<V逆的点是( )
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
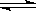 2SO3(g)测得开始时,SO2、O2、和SO3的浓度分别为0.2mol?L-1、0.1mol?L-1、0.2mol?L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是
2SO3(g)测得开始时,SO2、O2、和SO3的浓度分别为0.2mol?L-1、0.1mol?L-1、0.2mol?L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是| A.O2为0.15mol?L-1 | B.SO2为0.25mol?L-1 |
| C.SO3为0.4mol?L-1 | D.O2、SO3的浓度相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g),X2、Y2、Z起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,当平衡时,下列数据肯定不对的是( )
2Z(g),X2、Y2、Z起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,当平衡时,下列数据肯定不对的是( )| A.X2为0.4 mol·L-1,Y2为1.2 mol·L-1? | B.Y2为1.0 mol·L-1 |
| C.X2为0.3 mol·L-1,Z为0.2 mol·L-1?? | D.Z为0.7 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO2(g)+H2(g)。CO2的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是( )
CO2(g)+H2(g)。CO2的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是( )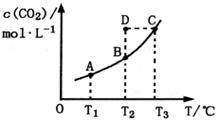
A.反应CO(g)+H2O(g) CO2(g)+H2(g)的ΔH>0 CO2(g)+H2(g)的ΔH>0 |
| B.在T2时,若反应处于状态D,则一定有v正<v逆 |
| C.平衡状态A与C相比,平衡状态A的c(CO)小 |
| D.恒压密闭容器中通入1mol CO(g)和1mol H2O(g),发生上述反应,当反应达到平衡后,在其他条件不变时,再通入1mol H2O(g)和1mol CO(g)的混合气体,v正、v逆反应速率随时间t变化的示意图如下。 |
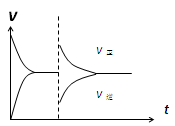
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
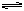 N2O4,测得NO2的转化率为a%,在其它条件不变的情况下,再充入1molNO2,待新平衡建立时,又测得NO2的转化率为b%。试问a、b值的大小关系为___ _。
N2O4,测得NO2的转化率为a%,在其它条件不变的情况下,再充入1molNO2,待新平衡建立时,又测得NO2的转化率为b%。试问a、b值的大小关系为___ _。
| A.负极的电极反应式为:CO+O2—―2e-=CO2 |
| B.工作时电极b作正极,O2-由电极a流向电极b |
| C.工作时电子由电极a通过传感器流向电极b |
| D.传感器中通过的电流越大,说明汽车尾气中CO的含量越高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学平衡描述的是可逆反应 |
| B.可逆反应达到化学平衡状态时,正、逆反应速率都为0 |
| C.可逆反应达到化学平衡状态时,v(正)=v(逆)≠0 |
| D.可逆反应达到化学平衡状态时,各组成成分浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
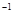 的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2。用上述 NaOH溶液与某一元弱酸HA 20.0mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10。求:
的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2。用上述 NaOH溶液与某一元弱酸HA 20.0mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10。求:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2HI(g)△H=-9.48 kJ/mol
2HI(g)△H=-9.48 kJ/mol  2HI(g)△H=+26.48 kJ/mol
2HI(g)△H=+26.48 kJ/mol
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 xC(g) 符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是( )
xC(g) 符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是( )| A.P3<P4,Y轴表示A2的转化率 | B.P3>P4,Y轴表示A2的浓度 |
| C.P3>P4,Y轴表示混合气体的密度 | D.P3>P4,Y轴表示混合气体的平均摩尔质量 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com