
| A. | 第一电离能:Al>Mg | B. | 水溶性:CH3CH2OH>CH3CH2OCH2CH3 | ||
| C. | 沸点:HCl>HF | D. | 晶格能:NaCl>MgO |
分析 A.同一主族元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素;
B.有机物的溶解性:醇>醚;
C.含有氢键的氢化物熔沸点较高;
D.离子化合物中晶格能与电荷成正比、与离子半径成反比.
解答 解:A.同一主族元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素,所以第一电离能Mg>Al,故A错误;
B.有机物的溶解性:醇>醚,所以溶解性CH3CH2OH>CH3CH2OCH2CH3,故B正确;
C.含有氢键的氢化物熔沸点较高,HF中含有氢键、HCl中不含氢键,所以熔沸点HF>HCl,故C错误;
D.离子化合物中晶格能与电荷成正比、与离子半径成反比,镁离子和氧离子电荷大于钠离子和锂离子,所以晶格能MgO>NaCl,故D错误;
故选B.
点评 本题考查元素周期律、晶格能、熔沸点等知识点,为高频考点,明确元素周期律、物质结构和性质的关系是解本题关键,注意氢化物的稳定性与化学键有关、氢化物的熔沸点与分子间作用力有关,为易错点.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:解答题
 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
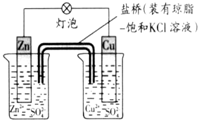
| A. | 正极反应为:Zn-2e-=Zn2+ | B. | Cu为负极,发生还原反应 | ||
| C. | 盐桥中的K+移向ZnSO4溶液 | D. | 在外电路中,电子从负极流向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg?L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在氧气中燃烧,火焰呈黄色,产生白色固体 | |
| B. | 红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 | |
| C. | 氢气在氯气中燃烧,发出苍白色火焰,同时产生白烟 | |
| D. | 钠投入水中,将沉在水底并熔化成小球,且有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应不一定伴随着能量的变化 | |
| B. | 氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=571.6kJ•mol-1 | |
| C. | 放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关D.所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 | |
| D. | 所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2在一定条件下可以支持燃烧 | B. | 该反应是一个放热反应 | ||
| C. | 该实验的反应中有O2生成 | D. | Na2O2可作为呼吸面具中氧气来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
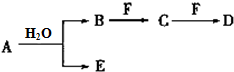 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题:
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题: ;D中所含化学键的类型离子键、共价键.
;D中所含化学键的类型离子键、共价键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com