


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:

| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3/100g水 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
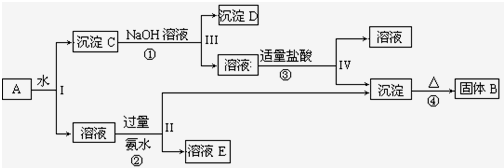
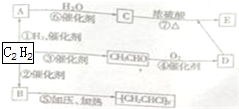 有机物A、B、C、D、E能发生如图所示的转化,其中C、D是生活中常见的有机物,E是具有特殊香味且不溶于水的液体.请回答下面有关问题:
有机物A、B、C、D、E能发生如图所示的转化,其中C、D是生活中常见的有机物,E是具有特殊香味且不溶于水的液体.请回答下面有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用明矾净化饮用水 |
| B、清晨林间透过缕缕阳光 |
| C、三氯化铁溶液中加入NaOH出现红褐色沉淀 |
| D、向煮熟的豆浆中加入石膏或卤水以生产豆腐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
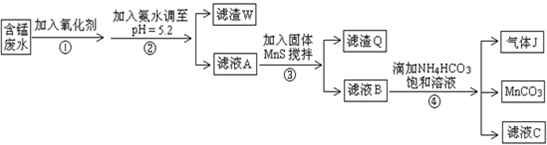
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
| 沉淀完全时的PH | 3.7 | 5.2 | 6.4 | 9.8 | ≥0 | ≥7 | ≥7 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO4═Na++H++SO42- |
| B、NaHCO3═Na++H++CO32- |
| C、MgCl2═Mg2++2Cl- |
| D、Ba(OH)2═Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质(括号内为杂质) | 除杂方法 | |
| A | CO2(O2) | 灼热的铜网 |
| B | FeCl2溶液(CuCl2) | 加入过量铁粉,过滤 |
| C | CaCl2溶液(盐酸) | 加入过量CaCO3,过滤 |
| D | CO2(CO) | 通入O2 点燃 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com