
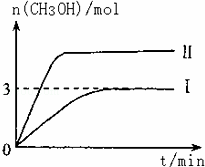
T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P.改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示.下列说法正确的是
( )
|
| A. | 曲线II对应的条件改变是减小压强 |
|
| B. | 若T2°C时上述反应的平衡常数为0.42,则T2<T1 |
|
| C. | 在T10C,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H2O(g),则达平衡前v(正)>v(逆) |
|
| D. | 在T10C,若起始时向容器中通入4.5molCO2、6mol H2,平衡时容器内的压强P1=P/2 |
| 化学平衡建立的过程;化学平衡的计算. | |
| 专题: | 化学平衡专题. |
| 分析: | A、曲线II达平衡时间更短,反应速率更快,根据压强和速率的关系来回答; B、根据放热反应:温度升高,K减小,反之,K增大来回答; C、根据浓度熵和K之间的关系确定化学反应的进行方向; D、根据压强对平衡移动的影响来回答判断. |
| 解答: | 解:A、曲线II达平衡时间更短,反应速率更快,不可能是压强减小的结果,故A错误; B、将9molCO2和12molH2充入3L密闭容器中,达到了平衡Ⅰ时, CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) 初始浓度:3 4 0 0 变化浓度:1 3 1 1 平衡浓度:2 1 1 1 此时K=0.5,该反应是放热反应:温度升高,K减小,反之,K增大,若T2°C时上述反应的平衡常数为0.42<0.5,所以T2>T1,故B错误; C、在T10C,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H2O(g),Qc= D、在T10C,若起始时向容器中通入4.5molCO2、6mol H2和T10C 时,将9molCO2和12molH2充入3L密闭容器中相比,投料减小一半,所以会引起平衡的逆向移动,平衡时容器内的压强P1> 故选C. |
| 点评: | 本题综合考查学生影响化学反应速率和平衡移动的因素知识,注意知识的灵活应用题,难度中等. |


科目:高中化学 来源: 题型:
根据下列几种物质熔点和沸点的数据,判断下列说法中错误的是( )
| NaCl | MgCl2 | AlCl3 | SiCl4 | 单质B | |
| 熔点/℃ | 810 | 710 | 190 | -68 | 2 300 |
| 沸点/℃ | 1 465 | 1 418 | 182.7 | 57 | 2 500 |
注:AlCl3熔点在2.5×105Pa条件下测定。
A.SiCl4是分子晶体
B.单质B是原子晶体
C.AlCl3加热能升华
D.MgCl2所含离子键的强度比NaCl大
查看答案和解析>>
科目:高中化学 来源: 题型:
利用海水制备部分物质的流程图如下。下列有关说法正确的是

A.电解熔融氯化镁制备镁,副产物氯气可以用于制盐酸,循环利用
B.联合制碱法最终副产物为氯化铵,原子利用率小于100%
C.步骤②的操作是:在空气中加热氯化镁晶体得到无水氯化镁
D.海水中离子的浓度较小,上述流程图只涉及溴元素的富集过程
查看答案和解析>>
科目:高中化学 来源: 题型:
将1molSO2和1molO2通入一容积不变的密闭容器中,在一定温度和催化剂作用下发生反应 SO2(g)+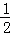 O2(g)⇌SO3(g).达到平衡后SO3为0.3mol,此时若移走0.5molSO2和0.5mol O2,则重新达到平衡后SO3物质的量为( )
O2(g)⇌SO3(g).达到平衡后SO3为0.3mol,此时若移走0.5molSO2和0.5mol O2,则重新达到平衡后SO3物质的量为( )
|
| A. | 等于0.3mol | B. | 等于0.15mol |
|
| C. | 小于0.15mol | D. | 大于0.15mol,小于0.3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:HCN(aq)+NaOH(aq)═NaCN(aq)+H2O(l)△H=﹣12.1kJ•mol﹣1;
HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H=﹣55.6kJ•mol﹣1
则HCN在水溶液中电离的△H等于( )
|
| A. | +43.5 kJ•mol﹣1 | B. | +67.7 kJ•mol﹣1 |
|
| C. | ﹣43.5 kJ•mol﹣1 | D. | ﹣67.7 kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图1和表(KMnO4溶液已酸化):
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol•L﹣1 H2C2O4溶液 | 30mL 0.01mol•L﹣1 KMnO4溶液 |
| ② | 20mL 0.2mol•L﹣1 H2C2O4溶液 | 30mL 0.01mol•L﹣1 KMnO4溶液 |
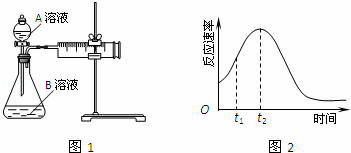
(1)写出草酸溶于水的电离方程式: .
(2)该实验探究的是 因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是:① ②(填:>、<、=).
(3)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4﹣)= mol/L.
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率.
(5)小组同学发现反应速率总是如2图,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热、② .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各种情况下一定能大量共存的离子组为( )
A.pH=7的溶液中:Fe3+、Cl-、Na+、NO
B.由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、CO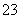 、Cl-、K+
、Cl-、K+
C.pH=1的溶液中:NH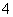 、Cl-、Cu2+、SO
、Cl-、Cu2+、SO
D.无色溶液中:Al3+、HCO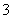 、I-、K+
、I-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
本题分三个部分,分别完成以下问题:
I. 下面列出了几组物质或粒子,请将合适的组号填写在空格上。
①金刚石与“足球烯”(C60)
②CH3CH2CH2CH(C2H5)CH3 和 CH3CH2CH2CH(CH3)C2H5
③235U、238U ④氧气(O2)与臭氧(O3)
⑤乙醇(CH3CH2OH)和甲醚(CH3OCH3) ⑥淀粉和纤维素
⑦ 
(1)是同素异形体的是 ,(填序号,下同)
(2)是同位素的是 ,
(3)是同分异构体的是 ,
(4)是同一物质的是 。
II. 下列物质:①Cl2 ②Na2O2 ③NaOH ④HCl ⑤C2H6 ⑥MgF2 ⑦HNO3
(1)只由离子键构成的物质是______________(填序号,下同)(2)由离子键和非极性键构成的物质是______________(3)由极性键和非极性键构成的物质是______________
III. 提纯下列物质(括号内的物质是杂质),请将所选用的除杂试剂和分离方法(填字母或者序号)填入对应的空格中(若不选,填“无”)
除杂试剂:A. 盐酸 B. 酸性高锰酸钾 C. 氢氧化钠溶液 D. (浓)溴水
E. H2(催化剂) F. CaO G. NaCl
分离方法:① 蒸馏 ② 分液 ③ 洗气 ④ 过滤
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| (1) | 酒精(水) | ||
| (2) | 乙烷(乙烯) | ||
| (3) | 硬脂酸钠溶液(甘油) | ||
| (4) | 苯(苯酚) | ||
| (5) | SiO2(Al2O3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com