
| A. | 2-甲基丁烷 | B. | 2-乙基丁烷 | ||
| C. | 3-甲基丁烷 | D. | 1,3,3-三甲基丙烷 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
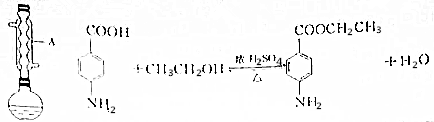
| 相对分子质量 | 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | 水中溶解性 | |
| 乙醇 | 46 | 0.789 | -117.3 | 78.5 | 与水互溶 |
| 对氨基苯甲酸 | 137 | 1.374 | 188 | 340 | 微溶 |
| 苯佐卡因 | 165 | 1.039 | 90 | 172 | 难溶 |
| 乙醚 | 74 | 0.71 | -116.3 | 35 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和AgCl水溶液中加入盐酸,Ksp(AgC1)变大 | |
| B. | AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) | |
| C. | 温度一定,当溶液中c(Ag+)c(Cl- )<Ksp(AgCl)时,此溶液中必有AgCl沉淀析出 | |
| D. | 向AgI的悬浊液中加NaCl浓溶液,可能有AgCl生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | S | SCl2 | S2Cl2 |
| 沸点/℃ | 445 | 59 | 137 |
| 熔点/℃ | 113 | -122 | -77 |
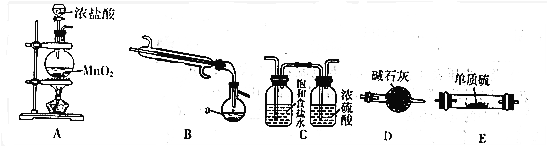
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度相同的Na2CO3和NaHCO3混合溶液中,c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+) | |
| B. | 0.1mol/L①醋酸②氯化铵③硫酸溶液中,水电离产生的氢离子浓度大小顺序是②>①>③ | |
| C. | 0.1mol/L的NaHCO3溶液中 C(Na+)+c(H+)=c(OH-)+c(HCO3-) | |
| D. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径C>D>E,三者形成的简单离子中D离子的半径最小 | |
| B. | 元素A所形成的氢化物常温下一定为气态 | |
| C. | 元素C、D、E在自然界中均不能以游离态存在 | |
| D. | 元素B的氧化物对应的水化物一定为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 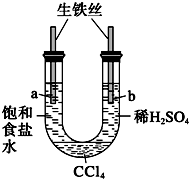 一段时间后,a管液面高于b管液面并且a处溶液的pH增大,b处溶液的pH 减小 | |
| B. |  继续煮沸溶液至红褐色,停止加热,当光束通过体系时无丁达尔效应 | |
| C. | 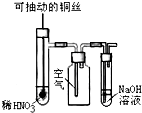 微热稀HNO3溶液片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 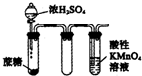 酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com