
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高二上期中化学试卷(解析版) 题型:填空题
科学家利用太阳能分解 水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以
水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以 甲醇为燃料的燃料电池。请回答下列问题:
甲醇为燃料的燃料电池。请回答下列问题:
(1)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+49.0kJ/mol
②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H=-192.9kJ/mol
由上述方程式可知,CH3OH(g)的燃烧热__________(填“大于”、“等于”或小于”)192.9kJ/mol。已知水的汽化热为44 kJ/mol,则表示氢气燃烧热的热化学方程式为__________________________。
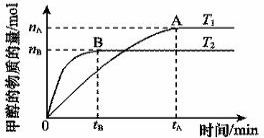
(2)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考查温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃)该反应为_________反应(填“放热”或“吸热”);在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平 衡后,若CO2转化率为a,则容器内的压强与起始压强之比为____________________。
衡后,若CO2转化率为a,则容器内的压强与起始压强之比为____________________。
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上第二次段考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是 ( )
A.Cl2与水反应:Cl2+ H2O = Cl-+ClO-+ 2H+
B.Fe溶于稀硝酸:2Fe+6H+ = 2Fe3++3H2↑
C.烧碱溶液中加入铝片:2Al+2OH-+2H2O = 2AlO2-+3H2↑
D.在稀氨水中通入过量CO2:2NH3·H2O+CO2 = 2NH4++CO32-+H2O
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上联考二化学卷(解析版) 题型:实验题
锌焙砂是锌精矿经焙烧后所得的产物,主要含ZnO、ZnSO4,有少量FeO、CuO、NiO杂质,是炼锌最主要的原料。某科研小组设计了如下提取金属锌的实验流程:
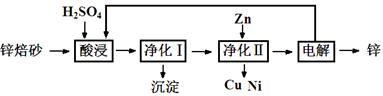
(1)酸浸时需要240 mL 4 mol·L-1稀H2SO4,用18.4 mol·L-1浓硫酸配制该稀H2SO4过程
中用到的玻璃仪器除烧杯、量筒、胶头滴管外,还要 、 ;酸浸得到的溶液中除Zn2+、Ni2+外,还含有的金属阳离子是 、 (填离子符号)。
(2)净化Ⅰ需要加入H2O2,加入H2O2时发生的离子反应方程式是 ;反应后控制溶液pH为4即沉淀完全,沉淀的主要成分是 。
(3)净化Ⅱ得到的Cu、Ni,需要进行洗涤操作,检验是否洗涤干净的方法是 ;本流程中可以循环利用的物质除锌外还有 、 。
(4)可用电解沉积硫酸锌溶液的方法制备锌,若在在阳极产生13.44L(标准状况下) 氧气,在阴极析出锌的质量为 。
(5)上述工艺中,如果不设计 “净化Ⅱ”,对提取金属锌造成的影响是____________________。
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上联考二化学卷(解析版) 题型:选择题
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g) + Y(g)  2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.0~2min的平均速率ν(Z) = 2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C.该温度下此反应的平衡常数K =1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源:2017届北京市海淀区高三上学期期末化学试卷(解析版) 题型:实验题
某小组同学利用下图装置对电解氯化铜实验进行了研究。
装置 | 现象 |
| 电解一段时间时,阳极石墨表面产生气体,阴极石墨上附着红色物质,烧杯壁变热,溶液由蓝色变为绿色 |
(1)甲认为电解过程中阳极产生的 是溶液变绿的原因,写出产生该物质的电极反应式: 。
(2)乙查阅资料,CuCl2溶液中存在平衡:Cu2+ + 4Cl_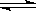 [CuCl4]2_(黄色) ΔH>0。据此乙认为:电解过程中,[CuCl4]2_(黄色)浓度增大,与CuCl2蓝色溶液混合呈绿色。乙依据平衡移动原理推测在电解过程中[CuCl4]2_浓度增大的原因: 。
[CuCl4]2_(黄色) ΔH>0。据此乙认为:电解过程中,[CuCl4]2_(黄色)浓度增大,与CuCl2蓝色溶液混合呈绿色。乙依据平衡移动原理推测在电解过程中[CuCl4]2_浓度增大的原因: 。
(3)丙改用下图装置,在相同条件下电解CuCl2溶液,对溶液变色现象继续探究。
装置 | 现象 |
| 电解相同时间时,阳极石墨表面产生气泡,溶液仍为蓝色;阴极石墨上附着红色物质,溶液由蓝色变为绿色;U型管变热,冷却后阴极附近溶液仍为绿色 |
丙通过对现象分析证实了甲和乙的观点均不是溶液变绿的主要原因。丙否定甲的依据是 ,否定乙的依据是 。
(4)丙继续查阅资料:
i. 电解CuCl2溶液时可能产生[CuCl2]_,[CuCl2]_掺杂Cu2+后呈黄色
ii. 稀释含[CuCl2]_的溶液生成CuCl白色沉淀据此丙认为:电解过程中,产生[CuCl2]_掺杂Cu2+后呈黄色,与CuCl2蓝色溶液混合呈绿色。
丙进行如下实验:
a.取电解后绿色溶液2 mL,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
b. 另取少量氯化铜晶体和铜粉,向其中加2 mL浓盐酸,加热获得含[CuCl2]_的黄色溶液。
c. 冷却后向上述溶液……
d. 取c中2 mL溶液,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
① a的目的是 。
② 写出b中生成[CuCl2]_的离子方程式: 。
③ 补充c中必要的操作及现象: 。
丙据此得出结论:电解时阴极附近生成[CuCl2]_是导致溶液变绿的原因。
查看答案和解析>>
科目:高中化学 来源:2017届北京市海淀区高三上学期期末化学试卷(解析版) 题型:选择题
新制氢氧化铜存在平衡:Cu(OH)2 + 2OH—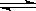 Cu(OH)42—(深蓝色)。某同学进行下列实验:
Cu(OH)42—(深蓝色)。某同学进行下列实验:
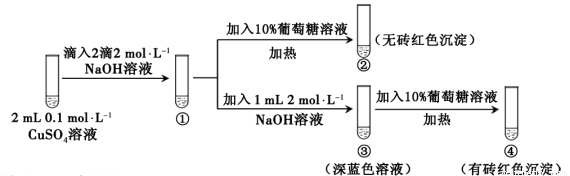
下列说法不正确的是
A. ①中出现蓝色沉淀
B. ③中现象是Cu(OH)2 + 2OH—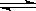 Cu(OH)42—正向移动的结果
Cu(OH)42—正向移动的结果
C. ④中现象证明葡萄糖具有还原性
D. 对比②和④可知Cu(OH)2氧化性强于Cu(OH)42—
查看答案和解析>>
科目:高中化学 来源:2017届广东省肇庆市高三上学期二模化学试卷(解析版) 题型:选择题
常温下,用0.1mol/LNaOH溶液滴定10 mL 0.1 mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列说法不正确的是( )
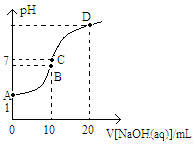
A.A点溶液中加入少量水: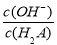 增大
增大
B.B点:c( HA -)>c(H+)>c(A2一)>c(H2A)
C.C点:c(Na+) =c(HA-)+2c( A2-)
D.水电离出来的c(OH -):B点>D点
查看答案和解析>>
科目:高中化学 来源:2017届广东省汕头市高三上学期期末化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】在研究金矿床物质组分的过程中,通过分析发现了Cu-Ni-Zn-Sn-Fe多金属互化物。
(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于 (填“晶体”或“非晶体”),可通过 方法鉴别。
(2)基态Ni2+的核外电子排布式 ;配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO FeO(填“<”或“>”)。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2分子中含有σ键的数目为 ;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H—S—C≡N)的沸点低于异硫氰酸(H—N=C=S)的沸点,其原因是 ;写出一种与SCN—互为等电子体的分子 (用化学式表示)。
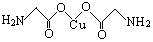
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为 。
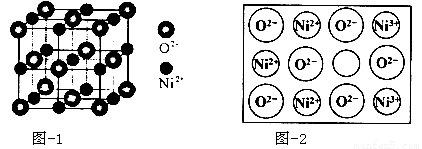
(5)立方NiO(氧化镍)晶体的结构如图所示,其晶胞边长为apm,列式表示NiO晶体的密度为 g/cm3(不必计算出结果,阿伏加德罗常数的值为NA)。人工制备的NiO晶体中常存在缺陷(如图):一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。已知某氧化镍样品组成Ni0.96O,该晶体中Ni3+与Ni2+的离子个数之比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com