
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是
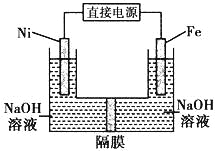
A. 镍是阳极,电极反应为4OH--4e一= O2↑+ 2 H2O
B. 电解时电流的方向为:负极→Ni电极→溶液→Fe电极→正极
C. 若隔膜为阴离子交换膜,则OH-自右向左移动
D. 电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
【答案】D
【解析】试题分析:A、因为该装置制备高铁酸盐,所以Fe发生氧化反应,则Fe作阳极,错误;B、Ni则作阴极,Fe与电源的正极相连,所以电流的方向是正极-Fe极-溶液-Ni极-负极,错误;C、若隔膜为阴离子交换膜,则氢氧根离子向阳极移动,自左向右移动,错误;D、阳极是Fe失去电子与氢氧根离子结合为FeO42-和水,所以阳极区氢氧根离子浓度减小,pH降低;而阴极是氢离子放电生成氢气,造成阴极区氢氧根离子浓度增大,pH升高,总反应是Fe+2H2O+2OH-= FeO42-+3H2,当撤去隔膜后,因为整体消耗氢氧根离子,所以溶液的氢氧根离子浓度减小,pH降低,正确,答案选D。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】扁桃酸衍生物是重要的医药中间体,以A和B 为原料合成扁桃酸衍生物F路线如下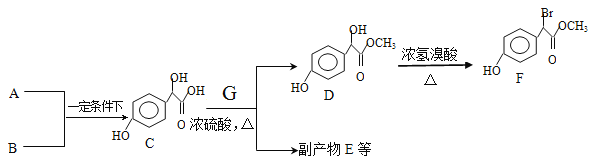
(1)根据流程图分析出G的命名 ,写出C和G反应生成D的反应方程式 。
(2)已知B为苯酚,A和B反应生成C的反应是加成反应。A可发生银镜反应,且具有酸性,则A的分子式为:_________。
(3)E是由2分子C生成的含有3个六元环的化合物,写出E的结构简式________。
(4)D→F的反应类型是__________,写出D→F的化学反应方程式 。
(5)符合下列条件的F的所有同分异构体(不考虑立体异构)的结构有 种。
①、属于一元酸类化合物,②、苯环上只有2个取代基且处于对位,其中一个是羟基
(6)A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)合成路线流程图示例如下:
合成路线的第一步已经写出,请在下面框中完成后续的合成路线流程图
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是由4个碳原子结合成的6种有机物(氢原子没有画出)。


(1)写出有机物(a)的系统命名法的名称__________。
(2)有机物(a)有一种同分异构体,试写出其结构简式__________。
(3)上述有机物中与(c)互为同分异构体的是__________ (填代号).
(4)任写一种与(e)互为同系物的有机物的结构简式__________。
(5)上述有机物中不能与溴水反应但能使其褪色的有__________(填代号)。
(6) (a) (b) (c)三种物质中,4个碳原子一定处于同一平面的有________ (填代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定温度下,某容积为2 L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如右图,依图所示:

(1)该反应的化学方程式是_____________________。
(2)在图上所示的三个时刻中,_______(填t1、t2或t3)时刻达到化学反应限度。
II.一定温度下将6 mol A及6 mol B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
(1)平衡时D的浓度=___________________。
(2)B的平均反应速率υ(B)= ___________________________。
(3)x=_________。
(4)开始时容器中的压强与平衡时的压强之比为______________(化为最简整数比)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把下列物质分别加入盛冷水的锥形瓶内,立即塞紧带U形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列
哪些物质后,发生如图变化( )

①NaOH粉末;②浓硫酸;③硝酸铵晶体;④过氧化钠固体;⑤生石灰
A.①②④⑤ B.①②③ C.②③⑤ D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香兰素是重要的香料之一,它可由丁香酚经多步反应合成。

有关上述两种化合物的说法正确的是
A. 常温下,1mol丁香酚只能与1molBr2反应
B. 丁香酚不能使FeCl3溶液发生显色反应
C. 1mol香兰素最多能与3mol氢气发生加成反应
D. 香兰素分子中至少有12个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】甲醇又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体.甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡.甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g)![]() CH3OH(l)+H2O(g) △H=Q1kJmol﹣1
CH3OH(l)+H2O(g) △H=Q1kJmol﹣1
又查资料得知:①CH3OH(l)+1/2O2(g)![]() CO2(g)+2H2(g) △H=Q2kJmol﹣1
CO2(g)+2H2(g) △H=Q2kJmol﹣1
②H2O(g)=H2O(l)△H=Q3kJmol﹣1,则表示甲醇的燃烧热的热化学方程式为 。
(2)甲醇燃料电池是符合绿色化学理念的新型燃料电池,下图是以甲醇燃料电池(甲池)为电源的电解装置.已知:A、B、C、D、E、F都是惰性电极,丙中为0.1mol/L CuSO4溶液 (假设反应前后溶液体积不变),当向甲池通入气体a和b时,D极附近呈红色.回答下列问题:
①a物质是 ,A电极的电极反应式为 。
②乙装置中的总化学反应方程式为 。
③当乙装置中C电极收集到224mL(标况下)气体时,丙中溶液的pH= 。
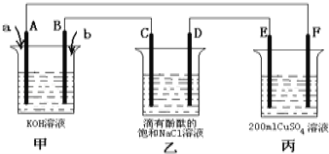
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A由碳、氢、氧三种元素组成。现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g。回答下列问题:
(1)3gA中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知前四周期六种元素A、B、C、D、E、F的核电荷数依次增大。B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成AC型离子化合物,其中的阴、阳离子相差一个电子层.E4+离子和氩原子的核外电子排布相同,F元素含量决定了人体内血红蛋白携氧能力的大小。请回答:
(1)A、B、C、D的第一电离能由小到大的顺序是__________(用元素符号填空)
(2)化合物BD3的分子构型为__________,B的原子轨道杂化类型为__________。B元素氢化物的沸点低于其同族上周期元素的氢化物的原因是__________。
(3)己知F2+与KCN溶液反应得F(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物.则F的基态原子价电子排布式为__________,CN-与__________(一种分子)互为等电子体.消除CN-剧毒性的方法之一是加入浓的双氧水,可将其转化为可溶性碳酸盐及氨气,写出该反应的离子方程式:__________。
(4)①E基态原子的价电子排布为__________,②EO2与碳酸钡在熔融状态下反应,所得晶体的晶胞结构如图所示,则该反应的化学方程式为__________。
③已知该晶体的摩尔质量为M(g/mol),其中E4+的氧配位数为__________。若该晶胞边长为anm,可计算该晶体的密度为__________g/cm3(阿伏加德罗常数为NA)。
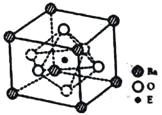
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com