
【题目】NaClO2的漂白能力是漂白粉的45倍,NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
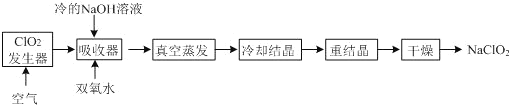
(1)吸收器中反应的离子方程式为________,吸收器中的反应温度不能过高,可能的原因_______。
(2)反应结束后,向ClO2发生器中通入一定量空气的目的:________。
(3) ClO2发生器中的反应为2NaClO3+SO2+H2SO4═2ClO2+2NaHSO4,实际工业生产中可用硫磺、浓硫酸代替反应原料中的SO2,其原因是______(用化学方程式表示)。
(4)某化学兴趣小组用如图所示装置制备SO2并探究SO2与Na2O2的反应:
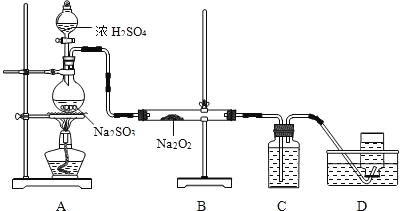
①为除去过量的SO2,C中盛放的试剂为______________。
②D中收集到的气体可使带余烬的木条复燃,B中硬质玻璃管内发生反应的化学方程式为_______。
③有同学认为B中硬质玻璃管内可能还有NaSO4生成。为检验是否有 Na2SO4生成,他们设计了如下方案:
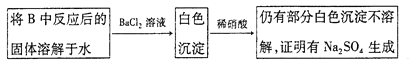
同学们经过讨论,认为上述方案不合理,其理由是:a____________;b_______________。
【答案】ClO2+2OH-+H2O2=2ClO2-+O2+2H2O 防止H2O2分解 驱赶出ClO2,确保其被充分吸收 S+2H2SO4(浓)![]() 3SO2↑+2H2O NaOH溶液(或KMnO4溶液) 2H2O2+2SO2=2Na2SO3+O2 稀硝酸能将亚硫酸钡氧化为硫酸钡 如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根
3SO2↑+2H2O NaOH溶液(或KMnO4溶液) 2H2O2+2SO2=2Na2SO3+O2 稀硝酸能将亚硫酸钡氧化为硫酸钡 如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根
【解析】
(1)吸收器中双氧水与ClO2在碱性条件下发生氧化还原反应生成NaClO2,根据电荷守恒和元素守恒可写出离子方程式,升高温度H2O2分解速率加快,据此分析解答;
(2)反应结束后,发生器中仍有少量ClO2,用空气可以将其排出,确保其被充分吸收;
(3)硫磺、浓硫酸可以反应生成二氧化硫;
(4)①二氧化硫是酸性氧化物,具有较强的还原性,据此选择试剂;②D中收集到的气体可使带余烬的木条复燃,说明有氧气产生,据此分析判断;③根据硝酸、Na2O2氧化性均很强,均能将SO32-氧化成SO42-分析判断。
(1)吸收器中双氧水与ClO2在碱性条件下发生氧化还原反应生成NaClO2,反应的离子方程式为2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O;为了防止H2O2分解,反应温度不能过高,故答案为:2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O;防止H2O2分解;
(2)反应结束后,发生器中仍有少量ClO2,用空气可以将其排出,确保其被充分吸收,故答案为:驱赶出ClO2,确保其被充分吸收;
(3)ClO2发生器中的反应为氯酸钠与二氧化硫在浓硫酸作用下发生氧化还原反应,而硫磺、浓硫酸也可以生成二氧化硫,反应的方程式为S+2H2SO4(浓)![]() 3SO2↑+2H2O,所以可用硫磺、浓硫酸代替原料中的SO2,故答案为:S+2H2SO4(浓)
3SO2↑+2H2O,所以可用硫磺、浓硫酸代替原料中的SO2,故答案为:S+2H2SO4(浓)![]() 3SO2↑+2H2O;
3SO2↑+2H2O;
(4)①二氧化硫是酸性氧化物,具有较强的还原性,能与氢氧化钠溶液或高锰酸钾溶液反应,所以C中盛放的试剂可以为NaOH溶液或KMnO4溶液,故答案为:NaOH溶液(或KMnO4溶液);
②D中收集到的气体可使带余烬的木条复燃,说明有氧气产生,所以B中发生的反应可能为二氧化硫与过氧化钠反应生成亚硫酸钠和氧气,反应的方程式为2Na2O2+2SO2=2Na2SO3+O2,故答案为:2Na2O2+2SO2=2Na2SO3+O2;
③反应后的固体溶解于水![]() 白色沉淀
白色沉淀![]() 仍有部分白色沉淀不溶解,不能证明有Na2SO4生成,因为:a.稀硝酸能将亚硫酸钡氧化为硫酸钡;b.如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根离子氧化成硫酸根离子,因此方案不合理,故答案为:稀硝酸能将亚硫酸钡氧化为硫酸钡;如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根。
仍有部分白色沉淀不溶解,不能证明有Na2SO4生成,因为:a.稀硝酸能将亚硫酸钡氧化为硫酸钡;b.如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根离子氧化成硫酸根离子,因此方案不合理,故答案为:稀硝酸能将亚硫酸钡氧化为硫酸钡;如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对某Na2CO3和NaHCO3的混合溶液的组成进行探究,取20.0mL该混合溶液,向其中不断加入1.00mol·L﹣1的稀盐酸,加入稀盐酸的体积和产生的现象如表中所示.
反应阶段 | Ⅰ | Ⅱ | Ⅲ |
稀盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
现 象 | 无气体 | 有气体 | 无气体 |
则混合溶液中c(HCO3﹣)为( )
A. 1.00mol·L﹣1 B. 0.50mol·L﹣1 C. 1.50mol·L﹣1 D. 2.00mol·L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的是( )
A. 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2= 2Fe3++2H2O
B. 电解饱和食盐水:2Cl-+2H2O![]() H2↑+C12↑+2OH-
H2↑+C12↑+2OH-
C. 铁和稀硝酸反应:Fe+ 2H+=Fe2++ H2↑
D. 硫酸氢钠溶液中逐滴加入氢氧化钡溶液直至溶液呈中性: H++ SO42- + OH-+ Ba2+ = BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.5gNa2CO3、NaHCO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸体积与产生CO2体积(标准状况)关系如图所示,下列说法中错误的是( )
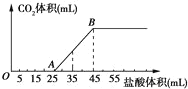
A. OA段发生反应的离子方程式为:H++OH═H2O
B. 当加入35mL盐酸时,产生CO2的体积为224mL
C. B点溶液中的溶质为NaCl
D. 混合物中Na2CO3、NaOH的总质量为2.06g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:
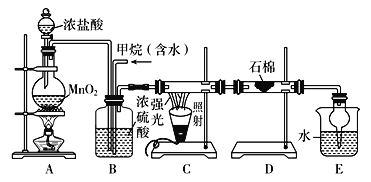
根据设计要求回答:
(1)B装置有三种功能:①控制气流速度; ②均匀混合气体; ③____________。
(2)设![]() =x,若理论上欲获得最多的氯化氢,则x取值范围________。
=x,若理论上欲获得最多的氯化氢,则x取值范围________。
(3)D装置的石棉中均匀混有KI粉末,其作用是______________。
(4)E装置的作用是________(填编号)。
A 收集气体 B 吸收氯气
C 防止倒吸 D 吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式:_______________________________________。
(6)E装置中除生成盐酸外,还含有有机物,从E中分离出有机物的最佳方法为________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填编号)。
a CH4 b CH3Cl c CH2Cl2 d CHCl3 e CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.8 g CO和0.2 g H2在足量的氧气中充分燃烧,使生成的CO2和水蒸气通过过量的过氧化钠,完全反应后固体的质量变化量是( )
A. 增加了3.0 gB. 减少了3.0 gC. 增加了2.6 gD. 减少了2.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包白色粉末,由BaCl2、K2SO4、CaCO3、NaOH、CuSO4中的一种或几种组成,为了探究它的成份,进行了如下实验:下列判断正确的是( )
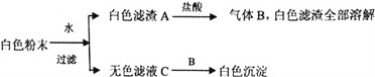
A.BaCl2、CaCO3一定存在,NaOH可能存在
B.K2SO4、CuSO4一定不存在
C.K2SO4、NaOH、CaCO3、BaCl2一定存在,K2SO4可能存在
D.C为单一溶质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法不正确的是( )
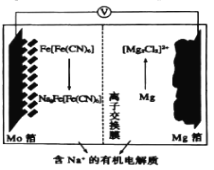
A.放电时,正极反应式:Fe[Fe(CN)6]+2Na++2e-=Na2Fe(Fe(CN)6]
B.充电时,Mg箔接电源的负极
C.充电时,Na+通过离子交换膜从左室移向右室
D.放电时,Mo箔增加4.6g时,Mg箔减少5.95g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com