
| A. | 酸性:HClO4>H3PO4>H2SiO3 | B. | 还原性:Na>Mg>Al | ||
| C. | 稳定性:HF>HCl>HBr | D. | 原子半径:Cl>S>O |
分析 A.非金属性越强,对应最高价氧化物的水化物酸性越强;
B.同周期从左向右金属性减弱;
C.非金属性越强,对应氢化物的稳定性越强;
D.电子层越多,原子半径越大;同周期原子序数大的原子半径小.
解答 解:A.非金属性Cl>P>Si,对应最高价氧化物的水化物酸性为HClO4>H3PO4>H2SiO3,故A正确;
B.同周期从左向右金属性减弱,则还原性:Na>Mg>Al,故B正确;
C.非金属性F>Cl>Br,对应氢化物的稳定性为HF>HCl>HBr,故C正确;
D.电子层越多,原子半径越大;同周期原子序数大的原子半径小,则原子半径:S>Cl>O,故D错误;
故选D.
点评 本题考查周期表和周期律的应用,为高频考点,把握元素的位置、元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ③⑤ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
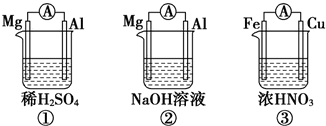
| A. | ①②中Mg作负极,③中Fe作负极 | |
| B. | ②中Al作正极,其电极反应式为Al-3e-=Al3+ | |
| C. | ③中Fe作负极,电极反应式为Fe-2e-=Fe2+ | |
| D. | 若①②中转移的电子数相同,则①②中产生的H2的量也一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食醋的主要成分是醋酸,它是一种弱酸 | |
| B. | 苯酚有毒,但可用于杀菌消毒 | |
| C. | 聚乙烯塑料制品可用于食品的包装 | |
| D. | 福尔马林可作食品的保鲜剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O | |
| B. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═Al(OH)4-+4NH4+ | |
| C. | 少量CO2通入苯酚钠溶液中:2C6H5O-+CO2+H2O═2C6H5OH+CO32- | |
| D. | 向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
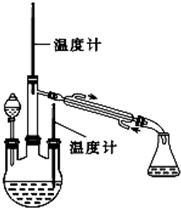 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
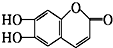 ,下列叙述不正确的是( )
,下列叙述不正确的是( )| A. | M的相对分子质量是178 | |
| B. | 1mol M最多能与2 mol Br2发生反应 | |
| C. | M与足量的NaOH溶液发生反应时,所得有机产物的分子式为C9H4O5Na4 | |
| D. | 1mol M与足量碳酸氢钠反应能生成2mol CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com