
分析 (1)同位素具有相同的质子数,不同中子数,其质量数不同,氢有三种同位素1H、2H、3H,2H和3H都是制造氢弹的原料;
(2)根据氢原子有三种同位素和氯原子有两种同位素,它们两两结合生成氯化氢进行判断;
(3)先计算H2O和D2O的物质的量,再计算分子中质子数之比和中子数之比;
解答 解:(1)氢元素质子数为1,具有相同的质子数,不同中子数互称为同位素,氢有三种同位素,分别为:1H氚(超重氢)、2H氘(重氢)、3H氚(超重氢),其中2H和3H都是制造氢弹的原料,
故答案为:氕(氢)、氘(重氢)、氚(超重氢);2H和3H;
(2)氢原子有三种同位素H、D、T,氯原子有两种同位素35Cl、37Cl,故氯化氢分子可能为:H35Cl、H37Cl、D35Cl、D37Cl、T35Cl、T37Cl,相对分子质量分别为:36、38、37、39、38、40,则形成的氯化氢分子的相对分子质量种类有5种,
故答案为:5;
(3)质量相同的H216O和D216O的物质的量之比为$\frac{1}{18}$:$\frac{1}{20}$=10:9,所以质子数之比为10:9,中子数之比为10×8:9×10=8:9,
故答案为:10:9; 8:9.
点评 本题考查了氢元素有三种同位素以及物质的量的计算、微粒中质子数和中子数的计算,侧重于原子结构的考查,注意氢原子的三种同位素和氯原子的两种同位素的组合,题目难度不大.


 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | X | |||
| W | Y | Z |
| A. | W的氧化物属于酸性氧化物,与一切酸都不能发生反应 | |
| B. | Z的单质可用于杀灭田鼠 | |
| C. | Y、Z的最高价氧化物对应的水化物的酸性:Y>Z | |
| D. | X、Y的氢化物的沸点:Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
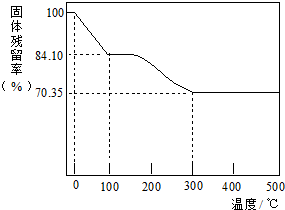
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
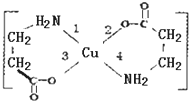 II.二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图:
II.二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其NMR谱中有两个信号峰,强度之比为3:1.
,其NMR谱中有两个信号峰,强度之比为3:1.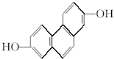 的有机物,在NMR谱上观察峰给出的强度之比为1:1:1:1:1;
的有机物,在NMR谱上观察峰给出的强度之比为1:1:1:1:1;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知V、W、X、Y、Z是原子序数一次增大的短周期主族元素,V、Y在周期表中的相对位置如表所示,V元素与氧元素能形成两种无色气体,X是地壳中含量罪所的金属元素,请回答下列问题:
已知V、W、X、Y、Z是原子序数一次增大的短周期主族元素,V、Y在周期表中的相对位置如表所示,V元素与氧元素能形成两种无色气体,X是地壳中含量罪所的金属元素,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
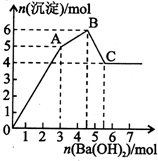 向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是( )
向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是( )| 氢氧化物 | 溶液pH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)3 | 2.3 | 3.4 | ||
| Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
| A. | 据图计算原溶液中c(Cl-)=c(SO42-) | |
| B. | OA段产生的沉淀为BaSO4和Fe(OH)3 | |
| C. | AB段可能发生的反应是:2SO42-+2Ba2++Al3++30H-=2BaSO4k+Al(OH)3↓ | |
| D. | C点溶液呈碱性的原因是AlO2-水解,其离子方程式为:AlO2-+2H2O=Al(OH)3+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,4,4-三甲基戊烷 | B. | 4-甲基-2-戊烯 | ||
| C. | 4-甲基-5-乙基庚烷 | D. | 1,2,4-三甲基丁烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com