
| A. | 置换反应 | B. | 分解反应 | C. | 化合反应 | D. | 复分解反应 |
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32gO2和O3的混合气体所含质子数一定为16NA | |
| B. | 标准状况下,11.2LSO2中含有的分子数为0.5NA | |
| C. | 常温下,5.6 g铁与硝酸反应,失去的电子数一定为0.3 NA | |
| D. | 39g钾与足量氧气充分反应,转移的电子数一定是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S、Si、Be | B. | O、C、Mg | C. | O、Si、Ca | D. | S、C、He |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ | B. | I- | C. | SO42- | D. | CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性强弱:F2<Cl2 | B. | 金属性强弱:K<Na | ||
| C. | 酸性强弱:H2SO4<HClO4 | D. | 碱性强弱:NaOH<Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用粗盐代替NaCl固体 | |
| B. | 定容时,溶液液面低于容量瓶刻度线 | |
| C. | 从烧杯向容量瓶转移溶液时,有少量溶液溅出 | |
| D. | 向容量瓶转移溶液时,容量瓶中有少量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
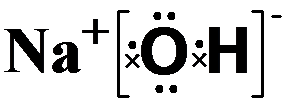 ,属离子化合物(填“离子”或“共价”).
,属离子化合物(填“离子”或“共价”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 粒子代号 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
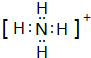 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com