实验室可有软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4.请回答:
(1)软锰矿制备K2MnO4的化学方程式是______ 3K2MnO4+KCl+3H2O
【答案】
分析:(1)根据反应物与生成物来书写反应方程式;
(2)根据反应物与生成物来书写反应方程式;
(3)利用化学反应方程式及二氧化锰的质量代入计算;
(4)根据KMnO
4能与热的经硫酸化的Na
2C
2O
4反应生成Mn
2+和CO
2,并利用质量守恒定律来书写反应方程式;
(5)利用(4)中的化学反应方程式及恰好与0.335g纯Na
2C
2O
4反应完全来计算.
解答:解:(1)由软锰矿与过量固体KOH和KClO
3在高温下反应,生成锰酸钾(K
2MnO
4)和KCl,则反应为3MnO
2+6KOH+KClO
3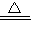
3K
2MnO
4+KCl+3H
2O,
故答案为:3MnO
2+6KOH+KClO
3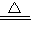
3K
2MnO
4+KCl+3H
2O;
(2)由滤液酸化后,K
2MnO
4转变为MnO
2和KMnO
4,则反应为3MnO
42-+4H
+═MnO
2↓+2MnO
4-+2H
2O,
故答案为:3MnO
42-+4H
+═MnO
2↓+2MnO
4-+2H
2O;
(3)由3MnO
2+6KOH+KClO
3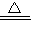
3K
2MnO
4+KCl+3H
2O、3MnO
42-+4H
+═MnO
2↓+2MnO
4-+2H
2O可知,反应物和生成物间的计量关系为:
MnO
2→K
2MnO
4→KMnO
4 87 158×

2.5×80% x
x=
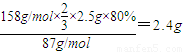
,
答:KMnO
4的理论产量是2.4g;
(4)由KMnO
4能与热的经硫酸化的Na
2C
2O
4反应生成Mn
2+和CO
2,则反应为2KMnO
4+5Na
2C
2O
4+8H
2SO
4 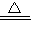
K
2SO
4+2MnSO
4+5Na
2SO
4+10CO
2+8H
2O,
故答案为:2KMnO
4+5Na
2C
2O
4+8H
2SO
4 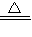
K
2SO
4+2MnSO
4+5Na
2SO
4+10CO
2+8H
2O;
(5)设该KMnO
4的纯度为y,根据2KMnO
4+5Na
2C
2O
4+8H
2SO
4 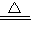
K
2SO
4+2MnSO
4+5Na
2SO
4+10CO
2+8H
2O可知,
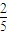
KMnO
4---Na
2C
2O
4 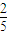
×158 134
0.165×y 0.335
y=
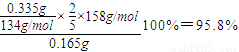
,
答:该KMnO
4的纯度为95.8%.
点评:本题考查化学反应方程式的书写及有关氧化还原反应的计算,明确反应物与生成物及物质之间的关系是解答的关键,难度不大.

 3K2MnO4+KCl+3H2O,
3K2MnO4+KCl+3H2O, 3K2MnO4+KCl+3H2O;
3K2MnO4+KCl+3H2O;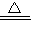 3K2MnO4+KCl+3H2O、3MnO42-+4H+═MnO2↓+2MnO4-+2H2O可知,反应物和生成物间的计量关系为:
3K2MnO4+KCl+3H2O、3MnO42-+4H+═MnO2↓+2MnO4-+2H2O可知,反应物和生成物间的计量关系为:
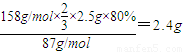 ,
,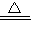 K2SO4+2MnSO4+5Na2SO4+10CO2+8H2O,
K2SO4+2MnSO4+5Na2SO4+10CO2+8H2O,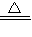 K2SO4+2MnSO4+5Na2SO4+10CO2+8H2O;
K2SO4+2MnSO4+5Na2SO4+10CO2+8H2O;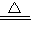 K2SO4+2MnSO4+5Na2SO4+10CO2+8H2O可知,
K2SO4+2MnSO4+5Na2SO4+10CO2+8H2O可知,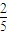 KMnO4---Na2C2O4
KMnO4---Na2C2O4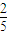 ×158 134
×158 134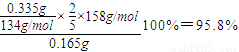 ,
,
