
三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为+6价Cr。制三氯化铬的流程如下:
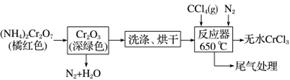
(1)重铬酸铵分解产生三氧化二铬(Cr2O3),其分解的化学方程式为________________________________________________________________________。
(2)已知CCl4沸点为57.6 ℃,为保证稳定的CCl4气流,适宜的加热方式是______________。
(3)用如图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400 ℃,开始向三颈烧瓶中通入氮气,使CCl4蒸气经氮气载入反应室进行反应,继续升温到650 ℃;③三颈烧瓶中装入150 mL CCl4,并加热CCl4,温度控制在50~60 ℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通入氮气;⑥检查装置气密性。正确的顺序:⑥→③→________________,步骤②中通入氮气的目的是________________________________________________________________________。
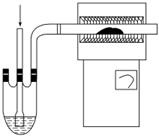
(4)已知反应管中发生的主要反应有Cr2O3+3CCl4—→2CrCl3+3COCl2,因光气有剧毒,故实验需在通风橱中进行,并用浓氨水处理COCl2,生成两种常见的氮肥,它们分别是__________________(写名称)。
(5)样品中三氯化铬质量分数的测定:
称取样品0.330 0 g,加水溶解并配成250 mL溶液。移取25.00 mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1 g Na2O2,充分加热煮沸,适当稀释,然后加入过量的2 mol·L-1 H2SO4至溶液呈强酸性,此时铬以Cr2O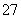 存在,再加入过量KI,塞上塞子,摇匀,于暗处静置5 min后,加入1 mL指示剂,用0.025 0 mol·L-1硫代硫酸钠标准溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00 mL。
存在,再加入过量KI,塞上塞子,摇匀,于暗处静置5 min后,加入1 mL指示剂,用0.025 0 mol·L-1硫代硫酸钠标准溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00 mL。
已知:Cr2O +6I-+14H+===2Cr3++3I2+7H2O,2Na2S2O3+I2===Na2S4O6+2NaI。
+6I-+14H+===2Cr3++3I2+7H2O,2Na2S2O3+I2===Na2S4O6+2NaI。
①该实验可选用的指示剂名称为______________。
②本实验除移液管、碘量瓶、烧杯外,还需要的玻璃仪器有______________。
③样品中无水三氯化铬的质量分数为________(计算结果精确到0.1%)。
答案 (1)(NH4)2Cr2O7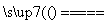 Cr2O3+N2↑+4H2O
Cr2O3+N2↑+4H2O
(2)水浴加热(并用温度计显示温度)
(3)②→④→⑤→① 排除装置中的空气,防止CrCl3被氧化
(4)尿素(或碳酰二胺)和氯化铵(或氯铵)
(5)①淀粉溶液
②250 mL容量瓶、碱式滴定管
③96.1%
解析 (1)由题中流程图得出,(NH4)2Cr2O7的分解产物为Cr2O3,另外产物为N2和H2O,可写出化学方程式。(2)为了保持温度恒定,采用加热方式为水浴加热(并用温度计显示温度)。(3)步骤②中通入氮气,可以排除装置中的空气,防止CrCl3被氧化。(4)用浓氨水处理COCl2,两者反应生成尿素(或碳酰二胺)和氯化铵(或氯铵)。(5)①反应过程中有碘单质生成,可以用淀粉溶液来作指示剂;②本实验需配制250 mL溶液,除了题给仪器外,还需250 mL容量瓶,另要进行滴定实验,故还需碱式滴定管;③据题意得关系式:2Cr3+~3I2~6Na2S2O3,故25 mL溶液中含Cr3+的物质的量为0.025 mol ·L-1×0.024 L÷3=2×10-4 mol,所以样品中三氯化铬的质量分数为10×2×10-4 mol×158.5 g·mol-1÷0.330 0 g×100%≈96.1%。


 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
下列方程式①AgCl(s)Ag+(aq)+Cl-(aq)、
②AgCl===Ag++Cl-、 ③CH3COOHCH3COO-+H+各表示什么意义?
查看答案和解析>>
科目:高中化学 来源: 题型:
N2在诸多领域用途广泛。某化学兴趣小组为探究在实验室制备较为纯净N2的方法,进行了认真的准备。请你参与交流与讨论。
[查阅资料]N2的制法有下列三种方案:
方案1:加热NaNO2和NH4Cl的浓溶液制得N2。
方案2:加热条件下,以NH3还原CuO可制得N2,同时获得活性铜粉。
方案3:将空气缓缓通过灼热的铜粉获得较纯的N2。
[实验准备]以实验室常见仪器(药品)等设计的部分装置如下图(部分夹持和加热仪器未画出)。
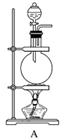
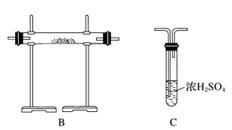

[分析交流]
(1)若以方案1制得N2,应选择的发生装置是___________________________。
(2)若按方案2制得干燥、纯净的N2,且需要的NH3以生石灰和浓氨水作原料,整套制气装置按气流从左到右的连接顺序是______________(填字母)。获得N2的反应原理是________________________________________________________________________(写反应方程式)。
(3)若以排水法收集N2,其中会混入水蒸气。但也不宜用排空气法,其原因是________________________________________________________________________。
你提出的收集方法是______________________________________。
(4)上述三个方案中,制得的N2纯度最差的是________。在N2纯度要求不甚严格的情况下,有人建议将方案2和方案3结合使用,你认为其优点是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化亚铜(CuCl)为白色晶体,微溶于水,能溶于氨水、浓盐酸,并生成配合物,不溶于硫酸、稀硝酸和醇,在工业上应用广泛。工业上制取氯化亚铜的工艺流程如下:
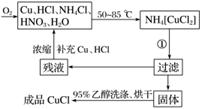
实验药品:铜丝20 g、氯化铵20 g、65%硝酸10 mL、36%盐酸15 mL、水。
(1)反应①的化学方程式为________________________________________________,
用95%乙醇代替蒸馏水洗涤的主要目的是____________________________________________
________________________________________________________________________(写出一条即可)。
(2)工业化生产时,95%乙醇可通过__________的方法回收并循环利用,而NH4Cl、____________(填化学式)可直接循环利用。
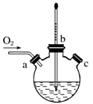
(3)实验室用右图装置制备CuCl。
①实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,最宜选择下列装置中的________(填字母)。
②实验开始时,温度计显示反应液温度低于室温,主要原因是________________________________________________________________________
________________________________________________________________________。
电炉加热升温至50 ℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色,从环保角度考虑,当______________________________时才能停止通入氧
气;待冷却至室温后,再打开瓶塞,沿________(填字母)口倾出棕色反应液于1 000 mL大烧杯中,加水500 mL,即有大量白色沉淀析出。
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应aA(g)+bB(g)cC(g)+dD(g),取a mol A和b mol B置于V L的容器中,1 min后,测得容器内A的浓度为x mol·L-1。这时B的浓度为______ mol·L-1,C的浓度为______ mol·L-1。这段时间内反应的平均速率若以物质A的浓度变化来表示,应为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度℃ | ||
| 浓度/(mol·L-1) | 体积/mL | 浓度/(mol·L-1) | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4溶液转化为MnSO4,每消耗1 mol H2C2O4转移________mol电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4)∶n(KMnO4)≥__________________________。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得KMnO4溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率
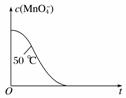
v(KMnO4)=________
mol·L-1·min-1。
(4)已知50 ℃时c(MnO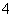 )~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO
)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO )~t的变化曲线示意图。
)~t的变化曲线示意图。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如下图所示,判断下列说法正确的是( )
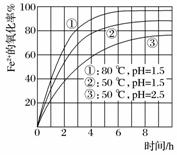
A.pH越小氧化率越大
B.温度越高氧化率越小
C.Fe2+的氧化率仅与溶液的pH和温度有关
D.实验说明降低pH、升高温度有利于提高Fe2+的氧化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com