
【题目】下列各组晶体中,化学键类型相同,熔化时所克服的作用力也完全相同的是( )
A.CO2和SiO2
B.Na和I2
C.蔗糖和干冰
D.金刚石和石墨
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
(1)将钠、铝、钾各1mol分别投入到足量的相同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈的单质是_____,与盐酸反应产生的气体最多的是______。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_____________________________。
(3)利用如图装置可验证同主族元素非金属性的变化规律:仪器A的名称为_________,装置D的作用为________________。

①若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液____________的现象,即可证明;从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气。
②若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液出现白色沉淀的现象,即可证明。写出C中发生反应的离子方程式____________________________(假设进入C中的气体过量),但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有_________溶液的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价层电子对互斥理论预测H2S和CH2O分子的立体结构,两个结论都正确的是( )
A.直线形;平面三角形
B.V形;三角锥形
C.直线形;三角锥形
D.V形;平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛是乙烯聚合催化剂的重要成分,制备反应如下:
①TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4KJ/mol
②C(s)+1/2O2(g)=CO(g) △H2=-110.45 KJ/mol,下列说法正确的是

A. C的燃烧热为110.45KJ/mol
B. 反应①若使用催化剂,△Hl会变小
C. 反应①中的能量变化如图所示
D. 反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H=-45.5KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种重要的有机化工原料有机物X,如图是以它为初始原料设计出的转化关系图(部分产物、合成路线、反应条件略去)。Y是一种功能高分子材料。
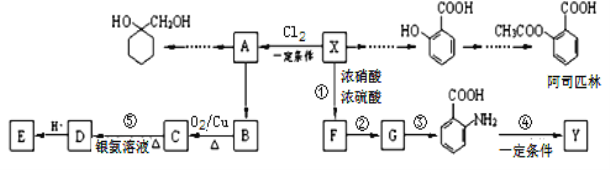
已知:(1)X为芳香烃,其相对分子质量为92
(2)烷基苯在高锰酸钾的作用下,侧链被氧化成羧基:![]()
(3)![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据本题所给信息与所学知识回答下列问题:
(1)X的分子式为___________;
(2)![]() 中含氧官能团的名称为___________________________;
中含氧官能团的名称为___________________________;
(3)反应①的反应类型是_______________;
已知A为一氯代物,则E的结构简式是____________________________________;
(4)反应④的化学方程式为___________________________________________________________;
(5)请写出以A为原料制备![]() 的合成路线流程图(无机试剂任用)。_________________。
的合成路线流程图(无机试剂任用)。_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中不正确的是
A.过滤时,玻璃棒与三层滤纸的一边接触
B.过滤时,漏斗下端紧贴烧杯内壁
C.分液时,上层液体要从分液漏斗上口倒出
D.向试管中滴加液体时,胶头滴管紧贴试管内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图图装置测定中和热的实验步骤如下:

①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。回答下列问题:
(1)倒入NaOH溶液的正确操作是________。
A.沿玻璃缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是________。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(3)实验数据如下表:①请填写下表中的空白:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ________ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似地认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热ΔH=____________________(取小数点后一位)。
③中和热测定实验中,下列操作一定会降低实验准确性的是________。
A.用滴定管(精量仪器,读数保留到0.01)取所用酸碱溶液的体积
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com