
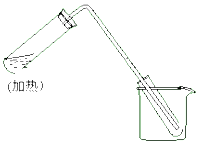
 如图是用自来水制取少量蒸馏水的简易装置,(加热及固定仪器略),其原理与教材中实验完全相同.回答下列问题:
如图是用自来水制取少量蒸馏水的简易装置,(加热及固定仪器略),其原理与教材中实验完全相同.回答下列问题:科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L的三氯甲烷所含的氢原子数为0.5NA | |
| B. | 7.2g丙烯酸分子中含有的双键数为0.2NA | |
| C. | 常温下,3.2g14C18O和16O2的混合物所含中子数为1.8NA | |
| D. | 足量Cu与Imol浓HNO3反应转移电子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 水电离出的OH-浓度:10c(OH-)A>c(OH-)B | |
| B. | 溶液的体积:10VA≤VB | |
| C. | 若分别用等浓度的氢氧化钠溶液完全中和,所得溶液的pH:A>B | |
| D. | 若分别与10mLpH=12的氢氧化钠溶液反应,所得溶液的pH:A≤B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaB溶液的pH=8,c(Na+)-c(B-)=0.99×10-6 mol•L-1 | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液,c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | 0.2mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合:(H+)=c(OH-)+c(HCO3-)+2c(H2CO3) | |
| D. | 0.1 mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8个 | B. | 7个 | C. | 6个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4=H2++SO42- | B. | Na2CO3=Na++CO32- | ||
| C. | NaHSO4=Na++H++SO42- | D. | Ca(OH)2=Ca2++2(OH)- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 SiCl4在室温下为无色液体,易挥发,有强烈的刺激性气味.工业上,提纯粗硅的原理如下:粗硅$→_{△}^{HCl}$SiCl4$→_{△}^{Si+H_{2}}$SiHCl3$→_{△}^{H_{2}}$Si(纯)
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性气味.工业上,提纯粗硅的原理如下:粗硅$→_{△}^{HCl}$SiCl4$→_{△}^{Si+H_{2}}$SiHCl3$→_{△}^{H_{2}}$Si(纯)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com