
实验设计是化学实验的重要技能之一。用所给装置(夹持装置省略)完成相关实验,最合理的选项是
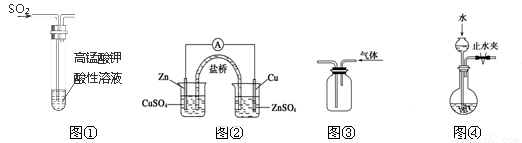
A.图①中KMnO4溶液紫红色褪去,说明SO2具有漂白性
B.图②能构成铜锌原电池
C.图③利用排空气法收集二氧化碳
D.图④检查装置气密性
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年河北省高三第五次调研考试化学试卷(解析版) 题型:选择题
下列实验操作对应的实验现象和解释或结论都正确的是
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 把S02通人紫色石蕊试液中 | 紫色褪去 | S02具有漂白性 |
B | 向NaOH溶液中滴加足量的MgCl2溶液, 然后再滴加足量的CuCl2溶液 | 先产生白色沉淀,然 后沉淀变蓝色 |
|
C | 向某溶液中滴加KSCN溶液 | 溶液变红色 | 溶液中含有Fe2+ |
D | 将充满N02的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2N2O4的△H<0 |
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
铝与过量的稀盐酸反应,为了加快反应速率,但是又不影响生成的氢气总量,可以采取的措施是
A.加入适量的铝粉 B.加入适量的水
C.加入少量的硫酸铜溶液 D.加入浓度较大的盐酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省濉溪县高三第二次月考化学试卷(解析版) 题型:选择题
常温下,下列各组微粒在指定溶液中一定能大量共存的是
A.0.1 mol·L-1 Fe(NO3)3溶液中:Mg2+、H+、SO42-、Cl-
B.0.1 mol·L-1 KClO溶液中:Na+、H+、Cl-、NO3-
C.0.1 mol·L-1氨水中:Ba2+、Ag+、NH4+、NO3-
D.c(OH-)=10-13 mol·L-1的溶液中:MnO4-、Na+、Br-、CH3CHO
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省安庆五校联盟高三下学期3月联考理综化学试卷(解析版) 题型:填空题
(16分)ZnO是电镀、涂料、有机合成等化学工业的重要原料。某课题组设计由含锌工业废料(含Fe、Cu、Mn等杂质)生产ZnO的工艺流程如下:
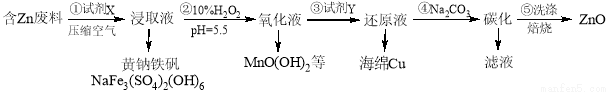
已知:黄钠铁矾在pH为1.5,温度为90℃时完全沉淀,且易于过滤。
2Cu +O2 +2H2SO4 == 2CuSO4+2H2O
(1)步骤①的浸取液里除含有Zn2+、Mn2+以外,还含有的金属离子有 、 ,所加试剂X为Na2SO4和_________的混合液。
(2)步骤②可进一步氧化除铁,还氧化除去了Mn2+,试写出相应的除去Mn2+的离子方程式_________________________,步骤③加入的试剂是_______,整个工艺流程中可以循环使用的试剂是_____________。
(3)步骤⑤中检验沉淀是否洗涤干净的操作方法是____________________________。
(4)步骤④碳化实际得到的是一种碱式碳酸锌[ZnCO3·xZn(OH)2·yH2O],取该样品7.18 g,充分灼烧后测得残留物质量为4.86 g,将所得气体通入足量澄清石灰水中,得到2.00 g沉淀,则此碱式碳酸锌的化学式是________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三下学期初考理综化学试卷(解析版) 题型:填空题
铜在工农业生产中有着广泛的用途。
(1)配制CuSO4溶液时需加入少量稀H2SO4,其原因是 (只写离子方程式)。
(2)某同学利用制得的CuSO4溶液,进行以下实验探究。
①图甲是根据反应Fe+CuSO4=Cu+FeSO4设计的原电池,请在图甲中的横线上完成标注。
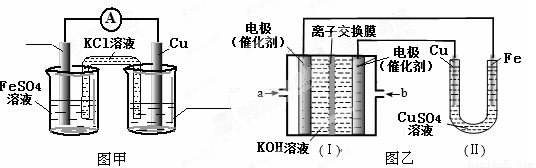
②图乙中,I是甲烷燃料电池的示意图,该同学想在II中实现铁上镀铜,则应在a处通入 (填“CH4”或“O2”),b处电极上发生的电极反应式为 ;若把II中电极均换为惰性电极,电解液换为含有0.1molNaCl溶液400mL,当阳极产生的气体为448mL(标准状况下)时,溶液的pH= (假设溶液体积变化忽略不计)。
(3)电池生产工业废水中常含有毒的Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去[室温下Ksp(FeS)=6.3×10-18mol2·L-2,K sp(CuS)=1.3×10-36mol2·L-2]。请结合离子方程式说明上述除杂的原理:当把FeS加入工业废水中后, 直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+。
sp(CuS)=1.3×10-36mol2·L-2]。请结合离子方程式说明上述除杂的原理:当把FeS加入工业废水中后, 直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三下学期初考理综化学试卷(解析版) 题型:选择题
下列关于阿佛加德 罗常数的说法正确的是
罗常数的说法正确的是
A.0.1 NA的NO在一密闭容器中与足量氧气完全反应,得到0.1 mol NO2
B.一定条件下的密闭容器中,6.4 g SO2可被氧气氧化得到SO3的分子数为0.1 NA
C.常温下18 g铝放入足量浓硫酸中转移电子数2 NA
D.1 L 0.1 mol/L FeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期中化学试卷(解析版) 题型:选择题
Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-;且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为
A.2:4:1 B.3:2:1 C.2:3:1 D.4:2:1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:实验题
(16分)
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 molL-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 molL-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 molL-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示步骤二中溶液变红的原因: 、 。
(2)甲探究步骤二中溶液褪色的原因:
I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III.向2 mL 0.1 molL-1 FeCl3溶液中滴加2滴0.1 molL-1 KSCN溶液,变红,通入O2,无明显变化。
实验I的说明 ;②实验III的目的是 。
得出结论:溶液退色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制 ① molL-1 的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH,约为3。由此,乙认为红色不褪去的可能原因是 ② 。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
步骤 | 试剂及操作 | 现 象 |
i | ③ | 生成白色沉淀 |
ii | 向i所得溶液中滴加0.1 molL-1 FeCl3溶液 | ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com