
用NA表示阿伏伽德罗常数,下列叙述正确的是( )
A.2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA
B.0.5molC3H8分子中所含C-H共价键数为2NA
C.标准状况下,22.4L乙醇完全燃烧所耗的氧气分子数为3NA
D.1mol碳正离子CH5+所含的电子数为11NA
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源:2015-2016学年重庆一中高一下学期期中化学试卷(解析版) 题型:选择题
设阿伏加德罗常数的数值为NA,下列说法不正确的是
A.1.6 g CH4中含有的C—H键数目为0.4 NA
B.0.1 mol CaO2中含有的阴、阳离子总数为0.2 NA
C.加热条件下足量的铜粉与含0.2 mol H2SO4的浓硫酸充分反应,转移电子数目为0.2 NA
D.标准状况下,2.24 L H37Cl含有的中子数为2.0 NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都七中高一下甲烷课后作业化学试卷(解析版) 题型:选择题
下列有机物分子中,相邻的五个原子可以构成一个正四面体的是( )
A.CHCl3 B.CH(CH3)3 C.CCl4 D.CH3CH3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西吉安一中高一下第二次段考化学试卷(解析版) 题型:选择题
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法错误的是( )
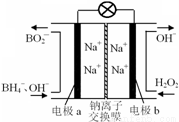
A.电池放电时Na+从a极区移向b极区
B.电极b采用MnO2,MnO2既作电极材料又有催化作用
C.每消耗3mol H2O2,转移的电子为3mol
D.该电池的a极反应为:BH4-+8OH--8e-═BO2-+6H2O
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三押题卷理综化学试卷(解析版) 题型:填空题
【物质与结构—选作】硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途。回答下列问题:
(1)写出基态镓原子的电子排布式 。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝 的晶体类型是 ;
的晶体类型是 ;
②写出Al2Cl6分子的结构式 ;
③单分子A1Cl3的立体构型是 ,缔合双分子
Al2Cl6中Al原子的轨道杂化类型是 。
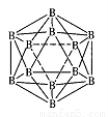
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),若其中有两个原子为10 B,其余为11B,则该结构单元有 种不同的结构类型。
(4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm-3,计算确定其晶胞的类型(简单、体心或面心立方)  ;晶胞中距离最近的铝原子可看作是接触的,列式计算铝的原子半径r(A1)= pm。
;晶胞中距离最近的铝原子可看作是接触的,列式计算铝的原子半径r(A1)= pm。
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三押题卷理综化学试卷(解析版) 题型:选择题
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是 ( )

A.溶液pH≤2时,生铁发生析氢腐蚀
B.在酸性溶液中生铁可能发生吸氧腐蚀
C.析氢腐蚀和吸氧腐蚀的速率一样快
D.两溶液中负极反应均为:Fe﹣2e﹣=Fe2+
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三最后一次模拟理综化学试卷(解析版) 题型:选择题
化学与人类生产、生活密切相关,下列说法正确的是
A.蚕丝和棉 花的组成元素相同,结构不同,因而性质不同
花的组成元素相同,结构不同,因而性质不同
B.汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的
C.古代的陶瓷、砖瓦、现代的玻璃、水泥等,都是硅酸盐产品
D.工业上通过电解熔融的氯化物制取Na、Mg、Al三种金属
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高二下期中化学试卷(解析版) 题型:简答题
甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1〈0
CH3OH(g) △H1〈0
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3〉0
CO(g)+H2O(g) △H3〉0
回答下列问题:
(1)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。

(2)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示。a(CO)值随温度升高而 (填“增大”或“减小”),其原因是 。图2中的压强由大到小为_____,其判断理由是_____。
(3)Bodensteins研究了下列反应:2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0. 784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数, 其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com