
【题目】NaNO2是一种食品添加剂,它与酸性KMnO4溶液可发生反应MnO ![]() +NO
+NO ![]() +X→Mn2++NO
+X→Mn2++NO ![]() +H2O(未配平).下列叙述中正确的是( )
+H2O(未配平).下列叙述中正确的是( )
A.生成1molNaNO3需消耗0.4molKMnO4
B.反应过程中溶液的pH减小
C.该反应中NO ![]() 被还原
被还原
D.X可以是盐酸
【答案】A
【解析】解:根据元素守恒及溶液酸碱性知,X是H+ , 该反应中Mn元素化合价由+7价变为+2价、N元素化合价由+3价变为+5价,转移电子数为10,反应方程式为2MnO4﹣+5NO2﹣+6H+=2Mn2++5NO3﹣+3H2O,A.根据方程式知,生成1molNaNO3需消耗0.4molKMnO4 , 故A正确;
B.反应中氢离子参加反应生成水,导致氢离子浓度减小,溶液的pH增大,故B错误;
C.该反应中亚硝酸根离子失电子被氧化,故C错误;
D.酸性高锰酸钾溶液具有强氧化性,能氧化氯离子生成氯气,所以不能是盐酸,可以是硫酸,故D错误;
故选A.
根据元素守恒及溶液酸碱性知,X是H+ , 该反应中Mn元素化合价由+7价变为+2价、N元素化合价由+3价变为+5价,转移电子数为10,反应方程式为2MnO ![]() +5NO
+5NO ![]() +6H+=2Mn2++5NO
+6H+=2Mn2++5NO ![]() +3H2O,据此分析解答.
+3H2O,据此分析解答.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】阴离子Xn﹣含中子N个,X的质量数为A,则ag X的氢化物中含质子的物质的量是( )
A.![]() (N﹣a)mol
(N﹣a)mol
B.![]() (n+A)mol
(n+A)mol
C.![]() (N+n)mol
(N+n)mol
D.![]() (A﹣N+n)mol
(A﹣N+n)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A为两种金属组成的合金,发生如下图所示的变化:
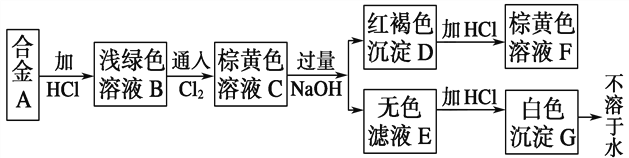
试填写以下空白:
(1)合金A由________和________组成。
(2)写出下列变化的离子方程式。
C→E______________________________________________________________;
D→F______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果Na+、Fe3+、NO3-和M四种离子以物质的量之比2∶1∶4∶1共存于同一溶液中,那么M可能是
A. Mg2+ B. OH- C. SO42- D. Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写错误的是( )
A.H2O=OH-+H+
B.Fe2(SO4)3=2Fe3++3SO42--
C.MgCl2=Mg2++2Cl-
D.Ba(OH)2=Ba2++2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质混合后发生化学反应,且属于离子反应的( )
A.NaOH溶液和K2SO4溶液混合B.锌片投入稀硫酸中
C.加热KClO3和MnO2固体混合物制O2D.H2和O2反应生成水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知给煤炭加氢可发生反应:C(s)+2H2(g)CH4(g).在VL的容器中投入amol碳(足量),同时通入2amolH2 , 控制条件使其发生上述反应,测得碳的平衡转化率随压强及温度的变化关系如下图所示.下列说法正确的是( ) 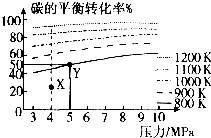
A.上述正反应为放热反应
B.在4MPa、1200K时,图中X点v(H2)正>v(H2)逆
C.在5MPa、800K时,该反应的平衡常数为 ![]()
D.工业上维持6MPa1000K而不采用10MPa1000K,主要是因为前者碳的转化率高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,针对表中的①—⑧八种元素,用元素符号或化学式回答相关问题:

(l)在这些元素中,化学性质最不活泼原子的原子结构示意图为______.
(2)用电子式表示①与③形成化合物的过程______.:
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是______. ,②、④的最高价氧化物对应水化物的溶液反应的离子方程式为:______.
(4)①②③④四种元素的简单离子半径由大到小的顺序是______.(用离子符号和“>”表示)。
(5)①⑤⑧三种元素的单质沸点由高到低的顺序是______.(用化学式和“>”表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com