
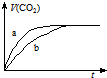
 现有两份大理石样品,一份是块状,一份是粉末状,在相同温度下,分别与100mL、1mol•L-1 的盐酸完全反应,实验测得生成CO2的体积与反应时间的关系如图所示.有关说法正确的是( )
现有两份大理石样品,一份是块状,一份是粉末状,在相同温度下,分别与100mL、1mol•L-1 的盐酸完全反应,实验测得生成CO2的体积与反应时间的关系如图所示.有关说法正确的是( )| A. | 两份大理石一定有剩余 | |
| B. | 两份盐酸一定反应完全 | |
| C. | 曲线a表示的是块状大理石样品与盐酸反应 | |
| D. | 曲线b表示的是块状大理石样品与盐酸反应 |
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
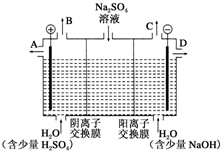 芒硝化学式为Na2SO4•10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
芒硝化学式为Na2SO4•10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④ | C. | ③④⑤ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④②③ | B. | ③①④② | C. | ③②①④ | D. | ③①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com