
【题目】
氯吡格雷是一种血小板聚集抑制剂,该药物以![]() 为原料的合成路线如图:
为原料的合成路线如图:
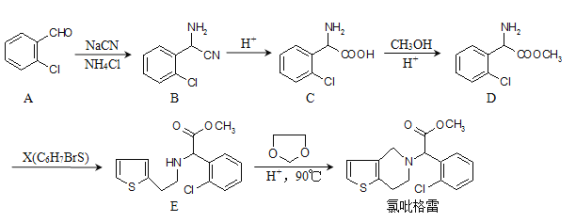
请根据以上信息,结合自己掌握的知识和具有的经验回答下列问题:
(1)分子C中无氧官能团的名称为____________。 命名为__________。
命名为__________。
(2)D→E的反应类型是_________反应。
(3)X的结构简式为___________________。
(4)下列叙述正确的是________(填序号)。
A.A物质中所有原子均可共面 B.C物质可发生取代、氧化、还原反应
C.![]() 在水中溶解度小 D.E中有两个手性碳原子
在水中溶解度小 D.E中有两个手性碳原子
(5)分子C在一定条件下生成一种含有3个六元环的产物的化学方程式为_____________。
(6)同时满足下列两个条件的B的同分异构体共有_____种(不包括B)。
①与B含有相同的官能团;②苯环上的取代基不超过2个。
(7)已知:![]() ,则由乙醇、甲醇为有机原料制备化合物
,则由乙醇、甲醇为有机原料制备化合物![]() 需要经历的反应类型有______(填序号)。
需要经历的反应类型有______(填序号)。
①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应
写出制备化合物![]() 的最后一步反应:______________________。
的最后一步反应:______________________。
【答案】 氨基、氯原子 2氯苯甲醛 取代 ![]() ABC
ABC 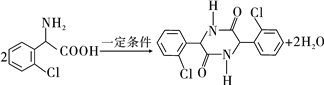 9 ①②③④ HOCH2CH2OH+HCHO
9 ①②③④ HOCH2CH2OH+HCHO![]()
![]() +H2O
+H2O
【解析】(1)分子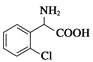 中除氯原子外的官能团名称为氨基、羧基;
中除氯原子外的官能团名称为氨基、羧基;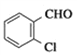 的名称是2氯苯甲醛;(2)由D、E的结构可知,D中氨基中H原子被取代生成D,属于取代反应;(3)对比D、E的结构确定X的结构简式为
的名称是2氯苯甲醛;(2)由D、E的结构可知,D中氨基中H原子被取代生成D,属于取代反应;(3)对比D、E的结构确定X的结构简式为![]() ;(4)A. 苯环和醛基均是平面形结构,则A物质中所有原子均可共面,A正确;B. C物质中含有苯环、氨基、羧基和氯原子,可发生取代、氧化、还原反应,B正确;C.
;(4)A. 苯环和醛基均是平面形结构,则A物质中所有原子均可共面,A正确;B. C物质中含有苯环、氨基、羧基和氯原子,可发生取代、氧化、还原反应,B正确;C.![]() 含有醚键,在水中溶解度小,C正确;D.与饱和碳原子相连的4个原子或原子团互不相同,该碳原子是手性碳原子,E中有1个手性碳原子,即与苯环相连的碳原子,D错误,答案选ABC;(5)两分子C可在一定条件下反应生成一种产物,该产物分子中含有3个六元环,则发生取代反应,生成-CO-NH-结构,
含有醚键,在水中溶解度小,C正确;D.与饱和碳原子相连的4个原子或原子团互不相同,该碳原子是手性碳原子,E中有1个手性碳原子,即与苯环相连的碳原子,D错误,答案选ABC;(5)两分子C可在一定条件下反应生成一种产物,该产物分子中含有3个六元环,则发生取代反应,生成-CO-NH-结构,
该反应为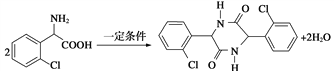 ;(6)①与B含有相同的官能团,即—Cl、—NH2、—CN,②苯环上的取代基不超过2个,应该是一个或二个,如果是二个则苯环上有邻、间及对位三种情况;如果是苯环只有一个取代其应该只用一种结构,如果是二个取代其,则可能是—Cl与
;(6)①与B含有相同的官能团,即—Cl、—NH2、—CN,②苯环上的取代基不超过2个,应该是一个或二个,如果是二个则苯环上有邻、间及对位三种情况;如果是苯环只有一个取代其应该只用一种结构,如果是二个取代其,则可能是—Cl与![]() 在间位与对位二种结构;可能是—NH2与
在间位与对位二种结构;可能是—NH2与![]() 有三种结构,可能是—CN与
有三种结构,可能是—CN与![]() 有三种情况,共9种;(7)乙烯与溴发生加成反应生成BrCH2CH2Br,再水解生成乙二醇,甲醇催化氧化生成HCHO,最后乙二醇与甲醛反应生成
有三种情况,共9种;(7)乙烯与溴发生加成反应生成BrCH2CH2Br,再水解生成乙二醇,甲醇催化氧化生成HCHO,最后乙二醇与甲醛反应生成![]() ,构成需要经历的反应类型有①②③④合成路线流程图为:
,构成需要经历的反应类型有①②③④合成路线流程图为: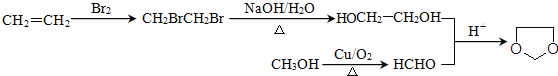 ,其中最后一步反应的方程式为HOCH2CH2OH+HCHO
,其中最后一步反应的方程式为HOCH2CH2OH+HCHO![]()
![]() +H2O。
+H2O。


科目:高中化学 来源: 题型:
【题目】(1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
2CO(g) +2NO(g) ![]() N2(g)+2CO2(g) △H1
N2(g)+2CO2(g) △H1
已知:CO的燃烧热△H2=-283kJ/moL
N2(g) +O2(g) =2NO(g)几种化学键的键能数据如下:
化学键 | N≡N键 | O=O键 | NO中氮氢键 |
键能(kJ/mol) | 945 | 498 | 630 |
求△H1__________________。
(2)NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划,在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行下述反应I,测得不同时间的NH3和O2的浓度如下表:
时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
C(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0. 0072 | 0.0072 |
C(O2)/mol·L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
则下列有关叙述中正确的是______________
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B. 若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
D.前10分钟内的平均速率v(NO)=0.088mol·L-1·min-1
<>(3)氨催化氧化时会发生下述两个竞争反应I、II。催化剂常具有较强的选择性,即专一性。已知:反应I 4NH3(g)+5O2(g)![]() 4NO(g) +6H2O(g)
4NO(g) +6H2O(g)
反应 II:4NH3(g)+3O2(g) ![]() 2N2(g) +6H2O(g)
2N2(g) +6H2O(g)
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如图:

①该催化剂在高温时选择反应____________ (填“ I ”或“ II”)。
② 520℃时,4NH3(g)+3O2![]() 4N2(g) +6H2O(g)的平衡常数K=________________ (不要求得出计算结果,只需列出数字计算式)。
4N2(g) +6H2O(g)的平衡常数K=________________ (不要求得出计算结果,只需列出数字计算式)。
③由图像可判断,反应I正反应△H_______________ 0(填“>”、“<”,或“=”)
④C点比B点所产生的NO的物质的量少的主要原因_________________________。
(4)羟胺(NH2OH)的电子式_____________,羟胺是一种还原剂,可用作显像剂还原溴化银生成银单质和氮气,该反应的化学方程式为______________________________。
现用25.00mL0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL 0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2016·天津]氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是 (至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式: 。
(2)氢气可用于制备H2O2。已知:
H2(g)+A(l) ![]() B(l) ΔH1
B(l) ΔH1
O2(g)+B(l) ![]() A(l)+H2O2(l) ΔH2
A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g) ![]() H2O2(l)的ΔH 0(填“>”、“<”或“=”)。
H2O2(l)的ΔH 0(填“>”、“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是 。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是 。
a.容器内气体压强保持不变
b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为 。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4。同时获得氢气:Fe+2H2O+2OH![]()
![]() +3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色
+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色![]() ,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH)降低的区域在 (填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因为 。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.煤制天然气的工艺流程简图如下:
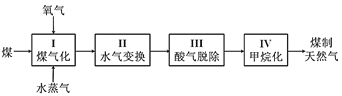
(1)反应Ⅰ:C(s) + H2O(g)![]() CO(g) + H2(g) ΔH =+135 kJ·mol1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:___________________________。
CO(g) + H2(g) ΔH =+135 kJ·mol1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:___________________________。
(2)反应Ⅱ:CO(g) + H2O(g)![]() CO2(g) + H2(g) ΔH=41 kJ·mol1。如图表示不同温度条件下,煤气化反应Ⅰ发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
CO2(g) + H2(g) ΔH=41 kJ·mol1。如图表示不同温度条件下,煤气化反应Ⅰ发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
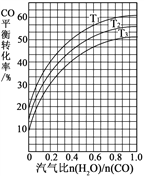
①判断T1、T2和T3的大小关系:______________。(从小到大的顺序)
②若煤气化反应Ⅰ发生后的汽气比为0.8,经煤气化反应Ⅰ和水气变换反应Ⅱ后,得到CO与H2的物质的量之比为1∶3,则反应Ⅱ应选择的温度是_______(填“T1”或“T2”或“T3”)。
(3)①甲烷化反应Ⅳ发生之前需要进行脱酸反应Ⅲ。煤经反应Ⅰ和Ⅱ后的气体中含有两种酸性气体,分别是H2S和_______。
②工业上常用热碳酸钾溶液脱除H2S气体得到两种酸式盐,该反应的离子方程式是__________。
Ⅱ.利用甲烷超干重整CO2技术可得到富含CO的气体,将甲烷和二氧化碳转化为可利用的化学品,在能源和环境上的意义重大。该技术中的化学反应为:
CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g) ΔH>0
2H2O(g)+4CO(g) ΔH>0
CH4超干重整CO2的催化转化原理示意如图:
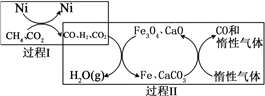
(4)过程Ⅱ,实现了含氢物种与含碳物种的分离。生成H2O(g)的化学方程式是______________。
(5)假设过程Ⅰ和过程Ⅱ中的各步均转化完全,下列说法正确的是_______。((填序号)
a.过程Ⅰ和过程Ⅱ中均含有氧化还原反应
b.过程Ⅱ中使用的催化剂为Fe3O4和CaCO3
c.若过程Ⅰ投料![]() =1,可导致过程Ⅱ中催化剂失效
=1,可导致过程Ⅱ中催化剂失效
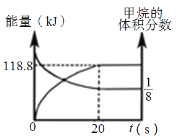
(6)一定条件下,向体积为2 L的恒容密闭容器中充入1.2 mol CH4(g)和4.8 mol CO2(g),发生反应CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g) ΔH>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,此反应的ΔH=________________。
2H2O(g)+4CO(g) ΔH>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,此反应的ΔH=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素原子序数依次喊小,原子半径的大小关系为:r(Y)>r(X)>r(Z), 三种元素的原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是( )

A. X元素位于ⅥA族 B. A难溶于B中
C. A和C不可能发生氧化还原反应 D. B的沸点高于C的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生存和发展的重要支柱,化学在能源的开发与利用方面起着十分重要的作用。某学习小组按如下图所示装置探究化学能与电能的相互转化:
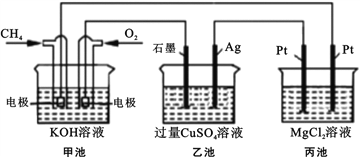
(1) 甲池是_____装置,通入CH4气体的电极上的反应式为_____。乙池中SO42- 移向_____电极(填“石墨”或“Ag”)
(2) 当甲池消耗标况下33.6LO2时,电解质KOH的物质的量变化_____mol,乙池若要恢复电解前的状态则需要加入_____g _____(填物质名称)。
(3) 丙池中发生的电解反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的CaCl2、MgCl2、Na2SO4 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
(1)判断BaCl2已过量的方法是___________________________________。
(2)第④步中,相关的离子方程式是_______________________________。
(3)为检验精盐纯度,需配230mL0.2mol/L NaCl(精盐)溶液,则需用托盘天平称取精盐固体的质量为_______g。
(4) 配制NaCl(精盐)溶液时需用容量瓶,其在使用前必须______ 。
(5) 配制NaCl(精盐)溶液时,若出现下列操作,其结果偏高的是__________
A.称量时NaCl已潮解 B.天平的砝码已锈蚀
C.定容摇匀后,液面下降又加水 D.定容时俯视刻度线
(6)将已配制好的浓度为C1 mol·L-1NaCl溶液与等质量的水混合后,此时溶液的浓度为C2 mol·L-1 ,则C1 与C2二者的关系为______。
A. C1=2C2 B.C1<2C2 C.C1>2C2 D.2C1<C2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com