
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
分析 根据化学式C3H5Cl可知,该化合物是含有碳碳双键的卤代烃,即相当于是丙烯中的1个氢原子被氯原子取代后的生成物,所以共计有3种.又因为1-氯-1丙烯存在顺反异构,所以总共是4种;也可以是环丙烷的一氯取代物.
解答 解:根据化学式C3H5Cl可知,该化合物是含有碳碳双键的卤代烃,即相当于是丙烯中的1个氢原子被氯原子取代后的生成物,所以共计有3种:CH2═CHCH2Cl、CHCl═CHCH3、CH2═CClCH3.又因为CHCl═CHCH3存在顺反异构,所以总共是4种,也可以是环丙烷的一氯取代物,共5种.
故选C.
点评 本题考查有机物的同分异构体的书写,难度不大,注意掌握同分异构体的书写方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 含有大量AlO2-的溶液中:K+、NH4+、Br-、HSO3-可以大量共存 | |
| B. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0 kJ•mol-1 | |
| C. | 将少量SO2通入NaClO溶液中:2ClO-+SO2+H2O═SO32-+2HClO | |
| D. | 在某钠盐溶液中含等物质的量的Cl-、I-、SO32-、CO32-、NO3-、SiO32-中一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但未见沉淀生成,则原溶液中一定有NO3-、I-和CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开盛浓盐酸的试剂瓶可看到白色的酸雾,这说明HCl不稳定 | |
| B. | 蔗糖中滴入浓硫酸,蔗糖变黑,这说明浓硫酸是氧化性酸 | |
| C. | 向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- | |
| D. | 碳酸、亚硫酸和次氯酸都是不稳定性酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 84 g NaHCO3晶体中含有NA个CO32- | |
| B. | 室温下,14.0 g乙烯和丁烯的混合气体中含有C-H键数目为2.0NA | |
| C. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| D. | 78 g Na2O2与足量的CO2反应,电子转移个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一氯代烷烃,随C原子数的增多,密度依次增大 | |
| B. | 常温下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 饱和一元羧酸,随C原子数的增多,酸性逐渐减弱 | |
| D. | 邻-二甲苯、间-二甲苯,对-二甲苯的沸点依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 容积 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O | H2 | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4+2NaOH═Na2SO4+2H2O | B. | CuO+H2 $\frac{\underline{\;\;△\;\;}}{\;}$ Cu+H2O | ||
| C. | NH3+HCl═NH4Cl | D. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
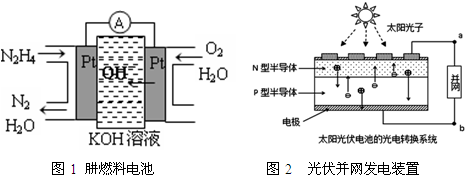
| A. | 氢氧燃料电池、太阳光伏电池中都利用了原电池原理 | |
| B. | 图1左边电极上发生的电极反应式为:N2H4-4e-+4OH-=N2+4H2O | |
| C. | 图2中N型半导体为正极,P型半导体为负极 | |
| D. | LED中的Ga和Y不可能都显+3价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com