
分析 (1)①先求出此反应的焓变,根据热化学方程式的书写规则再写出热化学方程式;
②根据反应热等于反应物的总键能减去生成物的总键能计算;
(2)依据氧化还原反应元素化合价变化分析判断,电池中负极上是氨气失电子生成氮气的反应.
解答 解:(1)①反应物总能量大于生成物总能量,应为放热反应,生成1mol氨气放出46.1kJ热量,则反应的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol;
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol;
②反应热等于反应物的总键能减去生成物的总键能,设N-H的键能为x,则945.8+3×436-6x=-92.2,x=391;
故答案为:391;
(2)原电池中负极失电子,氨气中氮元素化合价升高,发生氧化反应,该燃料电池的负极电极反应为:2NH3-6e-+6OH-=N2+6H2O;
故答案为:2NH3-6e-+6OH-=N2+6H2O.
点评 本题考查了热化学方程式和盖斯定律的分析应用,原电池原理的理解和电极反应的书写方法,题目难度中等.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:推断题
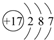 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
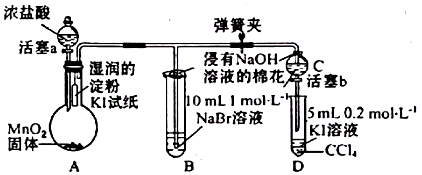
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
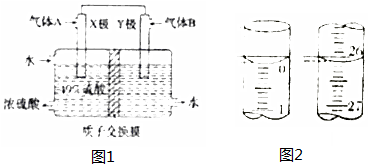
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
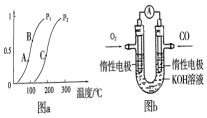 开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是一种共价化合物 | B. | 它受热时,不能分解产生有色气体 | ||
| C. | 它不可能与 NaOH 溶液反应 | D. | 它既含离子键又含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
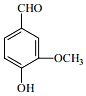 香荚兰豆的香气成分中含有的香草醛(如图)也称香兰素,常用做食品添加剂的原料,起着增香作用.请回答下列问题:
香荚兰豆的香气成分中含有的香草醛(如图)也称香兰素,常用做食品添加剂的原料,起着增香作用.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com