
| A. | 该晶体的熔沸点低、硬度小 | |
| B. | 晶体中碳原子数与C-O化学键数之比为1:2 | |
| C. | 晶体的空间最小环共有6个原子构成 | |
| D. | 该晶体中碳原子和氧原子的个数比为1:2 |
分析 A.该晶体结构和二氧化硅相似,属于原子晶体,原子晶体熔沸点较高;
B.该晶体中每个C原子和O原子形成4个C-O共价键;
C.根据二氧化硅结构知,该晶体中最小环上含有6个O原子;
D.该晶体中每个C原子连接4个O原子、每个O原子连接2个C原子.
解答 解:A.该晶体结构和二氧化硅相似,属于原子晶体,原子晶体熔沸点较高,所以该晶体熔沸点高、硬度大,故A错误;
B.该晶体中每个C原子和O原子形成4个C-O共价键,所以碳原子数与C-O化学键数之比为1:4,故B错误;
C.根据二氧化硅结构知,该晶体最小环上每两个C原子之间连接一个O原子,所以含有6个O原子,则该晶胞结构中最小环上含有12个原子,故C错误;
D.该晶体中每个C原子连接4个O原子、每个O原子连接2个C原子,所以该晶体中碳原子和氧原子的个数比为1:2,故D正确;
故选D.
点评 本题考查原子晶体,侧重考查学生分析判断及知识迁移能力,以二氧化硅结构特点为载体采用知识迁移方法分析该晶体结构,知道原子晶体构成微粒及空间构型,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:H2O>H2S>SiH4 | |
| B. | 离子半径:Cl->O2->Mg2+ | |
| C. | 物质酸性:H3PO4>H2SO4>HClO4 | |
| D. | 熔点:KCl>KI>K |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10的同分异构体有3种 | |
| B. | 分子组成是C5H10O2属于羧酸的同分异构体有5种 | |
| C. | 分子组成是C4H10O属于醇类的同分异构体有3种 | |
| D. | 结构为 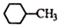 的物质的一溴代物有5种 的物质的一溴代物有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池 | |
| B. | 燃料电池是一种高效、对环境污染小的新型电池 | |
| C. | 化学电池的反应基础是氧化还原反应 | |
| D. | 铅蓄电池放电的时候负极是Pb正极是PbO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠投入水中,浮在水面熔成小球,并在水面快速移动,得到的溶液显碱性;Na+H2O═NaOH+H2↑ | |
| B. | 氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2+Cl2═2HCl | |
| C. | FeSO4溶液中加入NaOH溶液时,生成的白色絮状沉淀迅速变为灰绿色,最后变成红褐色; 2Fe(OH)2+O2+H2O═2 Fe(OH)3 | |
| D. | 向Na2SiO3溶液中逐滴加入稀盐酸,边加边振荡,有透明的硅酸凝胶产生;Na2SiO3+2HCl═H2SiO3(胶体)+2NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com